Клинико-экспериментальное обоснование оптимизации регенерации тканей после воздействия излучения Er:YAG-лазера
Представлены результаты клинико-экспериментальных и лабораторных исследований регенерации костной и мягких тканей после воздействия излучением Er:YAG-лазера с длиной волны 2940 нм у лабораторных животных и пациентов с заболеванием челюстно-лицевой области. Анализ результатов исследования показал интраоперационные и послеоперационные преимущества применения лазерных технологий, позитивное влияние лазерного излучения на регенерацию тканей, так как при этом быстрее проходит процесс заживления раны и восстановление костного дефекта. Клинические данные соответствуют данным гистологических и биохимических методов исследования.
Актуальность
Восстановление костной и мягких тканей челюстно-лицевой области является весьма актуальной проблемой, сложность которой заключается в том, что после оперативных вмешательств иногда развиваются воспалительные осложнения, формируются грубые рубцы и невосстанавливающиеся послеоперационные костные дефекты челюстей [1, 4, 5, 11]. Поэтому возникает необходимость поиска методов профилактики развития послеоперационных осложнений, которые, с учетом накопленных знаний о регенерации костной и мягких тканей челюстно-лицевой области и достижений в области высоких технологий, существенно повысили бы эффективность хирургического лечения пациентов за счет оптимизации регенерации тканей.
С этой целью нами была предпринята попытка изыскания альтернативных хирургическим инструментам методик, позволяющих обеспечить пациентам комфортные условия во время проведения операции и в послеоперационном периоде, позитивно влияющих на качество и скорость регенерации тканей. В связи с этим был осуществлен маркетинг выпускаемого на медицинский рынок современного оборудования, применяемого в хирургии. Многоплановый поиск позволил сделать выбор в пользу лазерных технологий, которые являются оптимальными с точки зрения рациональных, эстетических и технологических позиций.
В настоящее время в стоматологии широко используют эрбиевый (Er:YAG), эрбиево-хромовый (Er:YSGG) и углекислый (CO2) лазеры, длины волн которых соответствуют главным пикам поглощения водой
На сегодняшний день лазерная хирургия является одним из самых совершенных достижений мировой медицины и позволяет производить операции с меньшими травматичностью, кровотечением и болезненностью при хорошем обзоре операционного поля [6, 8, 11]. Лазерное воздействие основано на использовании свойств электромагнитных излучений, квантовых процессов и их влияния на волновые информационные свойства живых клеток. В отличие от химических препаратов медицинские лазеры не дают нежелательных побочных эффектов и оказывают избирательное воздействие на ткани человеческого организма [6—8, 10].
В настоящее время в стоматологии широко используют эрбиевый (Er:YAG), эрбиево-хромовый (Er:YSGG) и углекислый (CO2) лазеры, длины волн которых соответствуют главным пикам поглощения водой. В отношении последнего проводились многочисленные клинические и экспериментальные исследования, которые позволили определить спектр и широту воздействия на различные ткани [11]. Что же касается исследований по изучению влияния излучения эрбиевого лазера на твердые и мягкие ткани, то они немногочисленны, но весьма обнадеживающи [5].
Материалы и методы
В нашем исследовании объединены и обобщены результаты экспериментальных и клинических исследований по изучению влияния излучения эрбиевого лазера на регенерацию костной и мягких тканей. При этом было уделено внимание фундаментальным основам регенерации эпителиальной и соединительной тканей, составляющих основной объем тканей челюстно-лицевой области. В экспериментах на 392 животных (360 крысах и 32 кроликах) было изучено действие эрбиевого лазера с различными параметрами излучения на костную ткань и слизистую оболочку полости рта. Животным проводили деэпителизацию тканей и формирование костного дефекта как с помощью стандартного набора хирургических инструментов (скальпель, физиодиспенсер), так и эрбиевого лазера.
Вторым направлением нашего исследования явилось изучение влияния излучения эрбиевого лазера на процессы репарации у 675 пациентов обоих полов, 370 из которых провели лазерные операции по поводу стоматологических заболеваний. Особенности заживления раневой поверхности костной и мягких тканей оценивали по макроскопическим, морфологическим, биохимическим и рентгенологическим критериям.
Результаты исследования
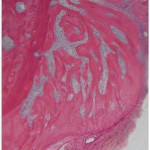
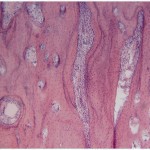
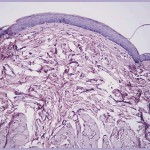
В группах животных, у которых дефект в костной ткани формировали с помощью излучения эрбиевого лазера в режиме абляции очень короткими (vsp) и короткими (sp) импульсами, наблюдалась сходная патоморфологическая картина. Во все сроки наблюдения процессы в зоне травмы костей согласуются с общими процессами остеогенеза, но в отличие от травмы, вызванной вращающимся инструментом, отмечается более быстрое очищение зоны травмы и ранняя активизация остеобластических элементов (рис. 1).
- Рис. 1а. 40-е сутки после нанесения травмы: а — с помощью физиодиспенсера; б — лазерным излучением. Окраска гематоксилином и эозином. Ок. 10. Об. 10.
- Рис. 1б. 40-е сутки после нанесения травмы: а — с помощью физиодиспенсера; б — лазерным излучением. Окраска гематоксилином и эозином. Ок. 10. Об. 10.
На 40-е суткипосле механической травмы определялись анастомозирующие костные балочки, в отдельных случаях встречались остатки волокнистой соединительной ткани, расположенные в центральной зоне дефекта. Клеточные элементы были представлены фибробластами и небольшим количеством макрофагов (рис. 1а).
После нанесения травмы излучением эрбиевого лазера в обоих режимах у подопытных животных наблюдалось полное восстановление кости в зоне дефекта с некоторым преимуществом при лазерном излучении очень короткими импульсами. Костные балочки новообразованной кости спаяны сохранившимися костными структурами, и границы между ними слабо различимы. Регенерат представлен типичной пластинчатой костной тканью (рис. 1б).
Следует также отметить, что после лазерного воздействия в этой зоне в 6 раз было меньше микротрещин, отсутствовали, в отличие от последствия механической травмы, признаки деструкции костной ткани.
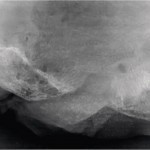
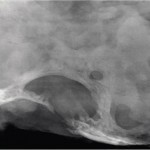
В опытах на кроликах было показано, что излучение эрбиевого лазера в режиме абляции не вызывало термического повреждения кортикального слоя костной ткани и способствовало быстрому формированию интермедиарной костной мозоли в зоне дефекта. В то же время при создании костного дефекта с помощью физиодиспенсера регенерация костной ткани осуществлялась медленнее за счет всех трех видов костной мозоли — эндостальной, периостальной и интермедиарной (рис. 2).
- Рис. 2а. Микрофокусная рентгенограмма с 20-кратным увеличением изображения после создания дефекта нижней челюсти кролика физиодиспенсером.
- Рис. 2б. Микрофокусная рентгенограмма с 20-кратным увеличением изображения после создания дефекта нижней челюсти кролика эрбиевым лазером.
Через 120 суток определялось полное замещение дефекта костной тканью, а в группе животных, у которых остеотомию осуществляли физиодиспенсером, определялось восстановление костной ткани, но без полного формирования кортикального слоя.
Известно, что процессы ремоделирования костной ткани в условиях физиологической перестройки и репаративного остеогенеза тесно связаны с факторами роста. В нашем исследовании регенерация костной ткани у животных после перфорации эпифиза бедренной кости крыс излучением эрбиевого лазера и ротационным механическим инструментом была изучена в динамике репарации по содержанию основного фактора роста фибробластов? (оФРФ-?), трансформирующего фактора роста 1? (ТФР-1?) и инсулиноподобного фактора роста 1 (ИФР-1) (табл. №1).
Таблица № 1. Исследование показателей регенерации костной ткани бедра крыс в динамике (М±m).
Показатели(нг/мг ткани) |
Группы |
Сроки регенерации костной ткани |
|||||
1 |
5 |
10 |
15 |
20 |
40 |
||
| оФРФ-? | Физиодисп. | 118±12,8 | 105±11,8 | 91,1±8,25 | 89,1±7,45 | 89,3±5,20 | 78,0±1,37 |
| Лазер | 87,9±10,4* | 121±23,7 | 93,5±4,21 | 78,1±3,88 | 112±21,4 | 92,3±6,71* | |
| ТФР-1? | Физиодисп. | 6,56±1,95 | 3,98±0,84 | 3,43±0,69 | 2,88±0,29 | 2,68±0,51 | 2,31±0,29 |
| Лазер | 3,39±0,36 | 3,19±0,32 | 3,61±0,76 | 3,83±0,71 | 3,41±0,57 | 1,97±0,18 | |
| ИФР-1 | Физиодисп. | 2,10±1,06 | 0,42±0,22 | 1,29±0,87 | 1,16±0,74 | 4,29±1,59 | 4,90±1,75 |
| Лазер | 5,45±3,74 | 3,93±1,06* | 2,68±0,92 | 0,29±0,19 | 3,51±1,43 | 7,80±1,86 | |
| Остеокальцин | Физиодисп. | 14,1±5,39 | 18,1±6,09 | 16,1±1,12 | 14,0±2,42 | 6,13±1,80 | 4,43±1,67 |
| Лазер | 18,1±6,68 | 16,1±5,27 | 4,83±1,71* | 7,66±1,10* | 6,28±1,70 | 4,83±0,93 | |
| ЩФ | Физиодисп. | 1,84±0,18 | 5,15±1,00 | 3,37±0,17 | 3,11±0,52 | 1,77±0,31 | 2,99±0,17 |
| Лазер | 1,58±0,15 | 1,67±0,32* | 2,40±0,52 | 3,55±0,29 | 1,13±0,28 | 1,49±0,33* | |
* р<0,05 — достоверность различий при сопоставлении 1-й и 2-й групп животных в динамике.
Регенерация поврежденных участков костной ткани происходит при тесном взаимодействии фибробластов с другими клетками. Фибробласты скапливаются в месте повреждения, активно дифференцируются и, кроме синтеза коллагена, способны вырабатывать такие факторы роста, как тромбоцитарный, трансформирующий 1?, фибробластов и эндотелиальный, синтезировать и другие белки межклеточного матрикса [10].
Этим определяется высокое количество оФРФ-? на 1-й и 5-й день после травмы вращающим инструментом, и только к 40-му дню опыта фиброгенез становится менее активным.
В то же время формирование межклеточного матрикса невозможно без увеличения количества клеток, дифференцировку и быстрый рост которых обеспечивает инсулиноподобный фактор роста 1 (ИФР-1). Также предполагается, что ИФР-1 участвует в формировании минеральной фазы, необходимой для восстановления зоны повреждения. С этих позиций, вероятно, можно объяснить волнообразное изменение количества ИФР-1 во все сроки опыта.
Формирование межклеточного матрикса невозможно без увеличения количества клеток, дифференцировку и быстрый рост которых обеспечивает инсулиноподобный фактор роста 1 (ИФР-1)
На первый день после механической травмы данный фактор участвует в росте и дифференцировке костных клеток, а на 20-е и 40-е дни он необходим для процессов минерализации. Но после воздействия эрбиевого лазера не наблюдалось существенных отличий до 40-го дня эксперимента в количестве выделяемого оФРФ-?, что, возможно, обусловлено коагуляцией кровеносных сосудов и отсроченной миграцией клеток крови. В то же время имеющееся на 40-й день более высокое содержание оФРФ-?наряду с повышенным уровнем ИФР-1 можно расценивать как процесс активного ангиогенеза, деления клеток и формирования не только белковой матрицы, но и минеральной фазы.
Трансформирующий фактор роста-1?, являющийся мощным иммунодепрессантом и индуктором синтеза белков межклеточного матрикса, играет важную роль. Наши результаты показывают, что именно в первые сутки после травмы вращающим инструментом наблюдалось наибольшее количество этого фактора роста и его снижение в последующем объясняется снижением скорости формирования межклеточного матрикса. В группах животных, костный дефект у которых вызывали излучением эрбиевого лазера, наблюдалось отсутствие отличий в содержании ТФР-1? во все сроки эксперимента, что, по всей видимости, следует рассматривать как активное формирование межклеточного матрикса в ране.
Образование костной ткани характеризуется секрецией остеобластами основного компонента межклеточного матрикса кости — коллагеновых белков, а также щелочной фосфатазы, остеокальцина и других белков, участвующих в минерализации костного остова [2].
Сходные результаты были получены и при клинических исследованиях, согласно которым, после лазерного воздействия регенерация и формирование зрелой костной ткани в области послеоперационного костного дефекта в челюстных костях проходит в более сжатые сроки, чем после воздействия вращающимся инструментом.
Неоднородность заполнения зоны костного дефекта новообразованной тканью после лазерной операции была также подтверждена результатами микрофокусной рентгенографии с денситометрией, которые показали, что плотность костной ткани через 1 месяц после операции цистэктомии была ниже, нежели после воздействия стандартных хирургических инструментов. Однако уже через 3 месяца после воздействия излучения эрбиевого лазера плотность костной ткани увеличивалась (рис. 3).
- Рис. 3а. Микрофокусная рентгенограмма (МФРГ) с денситограммой. Радикулярная киста верхней челюсти на уровне 2.1, 2.2 зубов, лазерная цистэктомия до операции.
- Рис. 3б. Микрофокусная рентгенограмма (МФРГ) с денситограммой. Радикулярная киста верхней челюсти на уровне 2.1, 2.2 зубов, лазерная цистэктомия через 1 месяц после операции.
- Рис. 3в. Микрофокусная рентгенограмма (МФРГ) с денситограммой. Радикулярная киста верхней челюсти на уровне 2.1, 2.2 зубов, лазерная цистэктомия через 3 месяца после операции.
- Рис. 3г. Микрофокусная рентгенограмма (МФРГ) с денситограммой. Радикулярная киста верхней челюсти на уровне 2.1, 2.2 зубов, лазерная цистэктомия через 6 месяцев после операции.
- Рис. 3д. Микрофокусная рентгенограмма (МФРГ) с денситограммой. Радикулярная киста верхней челюсти на уровне 2.1, 2.2 зубов, лазерная цистэктомия через 12 месяцев после операции.
Таблица № 2. Результаты оценки регенерации костной ткани с денситометрическим анализом плотности костной ткани (усл. ед.) по данным микрофокусной рентгенографии.
Сроки регенерациикостной ткани |
Группы исследования |
|
| Эрбиевый лазер | Традиционный метод | |
| Через 1 месяц | 170-180 | 180-190 |
| Через 3 месяца | 190-198 | 150-170 |
| Через 6 месяцев | 180-200 | 155-180 |
| Через 12 месяцев | 180-200 | 180-190 |
Тогда как в группах пациентов, которых оперировали стандартными хирургическими инструментами, вначале плотность костной ткани в зоне дефекта (через 1 месяц после операции) была выше, чем в группе оперированных лазером, а через 3 месяца значительно ниже. Она достигала нормальных величин только на 12 месяц заживления костного дефекта.
Таким образом, наши исследования показали особенности регенерации костной ткани после лазерного воздействия в виде начального восстановления структуры по периферии с постепенным сужением к центру, что приводит к сокращению сроков репаративного остеогенеза. После воздействия стандартными хирургическими инструментами процесс регенерации кости протекает более равномерно по всей площади дефекта, но медленнее.
Процессы репарации мягких тканей существенно отличаются от регенерации костной ткани. Мягкие ткани челюстно-лицевой области в основном представлены соединительнотканным матриксом и эпителиальной выстилкой, что и определяет особенность их реакции на повреждающие факторы. В эксперименте на животных изучались морфологические и метаболические изменения в слизистой оболочки щекипосле воздействия излучения эрбиевого лазера в режиме абляции длинными импульсами (lp). В клинической практике была дана оценка заживления мягких тканей полости рта по визуальным характеристикам, а также по результатам гистологического, биохимического и иммунологического методов исследования.
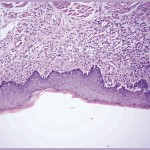
У лабораторных животных заживление дефекта слизистой оболочки щеки после лазерного воздействия происходило быстрее (рис. 4).
- Рис. 4а. Дефект слизистой оболочки крыс через 15 суток после нанесения эрбиевым лазером. Окраска гематоксилином и эозином, увеличение Х200.
- Рис. 4б. Дефект слизистой оболочки крыс через 15 суток после нанесения скальпелем.
Отличительной особенностью ран, нанесенных лазером, является слабая воспалительная реакция со стороны окружающих тканей на появление слоя асептического коагуляционного некроза. В ранах, нанесенных скальпелем, быстрее развивалось воспаление: в первые часы нейтрофилы формировали лейкоцитарный вал, а по краям раны формировались гематомы и развивался выраженный коллатеральный отек.
В ране, нанесенной лазером, отек и лейкоцитарная инфильтрация были выражены слабее. Этому, по всей вероятности, способствовал термический эффект лазерного излучения, который вызывал тромбоз мелких сосудов, дегидратацию и уплотнение коагулированной ткани. Белки таких тканей с трудом гидролизуются под действием протеиназ и не могут быстро освобождать вазоактивные вещества.
Особенность регенерации костной ткани после лазерного воздействия в виде начального восстановления структуры по периферии с постепенным сужением к центру приводит к сокращению сроков репаративного остеогенеза
Гистологическая картина раневых дефектов, сформированных лазером, через 15 суток характеризовалась тем, что эпителий ран уже мало отличается от интактного эпителия по толщине и степени дифференцировки. Под эпителием располагается фиброзно-рубцовая ткань, состоящая из рыхлых коллагеновых пучков с умеренным количеством фибробластов и с минимальным содержанием лимфоцитов и макрофагов (рис. 4а). Все это свидетельствует о постепенной инволюции рубцовой ткани, которая уже мало отличается от интактной ткани слизистой оболочки. В скальпельном дефекте эпителий гипертрофирован по сравнению с интактным эпителием, но уже хорошо дифференцирован. Под эпителием еще сохраняется грануляционная ткань в стадии фиброзирования, однако там еще не закончилась трансформация в рубцово-фиброзную ткань (рис. 4б). Об этом свидетельствует повышенное количество сосудов и фибробластов, а также остающаяся лимфо-макрофагальная инфильтрация.
Известно, что процессы деструкции и пролиферации, протекающие после повреждения тканей, находятся под сложным гуморальным контролем различных цитокинов, в том числе интерлейкинов, которые регулируют действие моноцитов, гранулоцитов и макрофагов, участвующих в очищении раны для последующей ее регенерации. Ряд цитокинов ИЛ-1?, ИЛ-8, ИЛ-6, фактор некроза опухоли –? обладают мощной провоспалительной и катаболической активностью. Показано, что ИЛ-1? играет предоминантную роль в деструкции тканей, активирует синтез Т-лимфоцитов, что свидетельствует об активации иммунного ответа в ответ на повреждение целостности ткани [9].
В то же время противовоспалительный цитокин ИЛ-4 ингибирует развитие Т-клеток воспаления, так как блокирует выработку ИЛ-1?. К противовоспалительным цитокинам также относится и ИЛ-10. Эти белки принимают активное участие в процессах регенерации тканей при повреждении [2]. Проведенное нами исследование показало, что в ране, сформированной излучением эрбиевого лазера, пик воспалительной реакции наблюдался на 2-е сутки и в последующие сутки заживления начинал стихать (табл. № 3).
Таблица № 3. Исследование показателей, отражающих заживление слизистой оболочки щеки крыс в динамике (М±m).
Показатели (пг/мг ткани) Группы |
Сроки регенерации костной ткани |
||||||
Контроль-ная |
1 |
2 |
3 |
5 |
7 |
||
| ИЛ-1? | Скальпель | 0,41±0,06 | 0,58±0,23 | 0,46±0,12 | 0,50±0,09 | 0,31±0,07 | 0,37±0,08 |
| Лазер | 0,33±0,06 | 0,95±0,24* | 0,38±0,10 | 0,50±0,09 | 0,42±0,06 | ||
| ИЛ-4 | Скальпель | 0 | 13,8±1,84 | 18,6±3,57 | 18,0±1,31 | 20,0±2,80 | 15,4±1,46 |
| Лазер | 5,98±1,65* | 11,9±2,06 | 12,0±1,96 | 15,5±1,54 | 15,2±2,00 | ||
| ИЛ-6 | Скальпель | 4,00±0,25 | 3,37±0,82 | 3,22±0,46 | 3,49±0,26 | 3,26±0,45 | 3,07±0,58 |
| Лазер | 4,12±0,20 | 5,50±0,10 | 2,85±0,34 | 3,93±0,31 | 3,80±0,29 | ||
| ИЛ-10 | Скальпель | 0 | 76,5±21,4 | 42,3±10,1 | 18,0±0,93 | 20,6±4,28 | 30,0±4,83 |
| Лазер | 21,8±4,22* | 32,6±5,55 | 30,0±3,40* | 34,2±4,11 | 32,1±3,51 | ||
| проММП-1 | Скальпель | 0,25±0,01 | 0,22±0,01 | 0,21±0,01 | 0,21±0,008 | 0,22±0,008 | 0,24±0,008 |
| Лазер | 0,21±0,008 | 0,23±0,01 | 0,22±0,01 | 0,22±0,01 | 0,24±0,02 | ||
| ТИМП-1 | Скальпель | 12,7±1,28 | 8,16±2,25 | 8,78±3,50 | 8,64±1,64 | 6,36±0,96 | 6,26±0,90 |
| Лазер | 5,52±0,80* | 8,24±2,24 | 5,63±1,63* | 6,26±0,79 | 8,64±1,00 | ||
* р<0,05 — достоверность различий при сопоставлении 1-й и 2-й групп животных в динамике.
Под действием режущего инструмента реакция воспаления в ране начинается уже на первые сутки, и воспалительный процесс протекает более интенсивно.
Повреждение тканей характеризуется активацией свободно-радикальных процессов с образованием супероксиданионов и других соединений. Для ферментативных антиоксидантов характерны высокая специфичность, строго определенная органная и клеточная локализация, а также использование в активном центре ионов металлов Cu, Fe, Mn, Zn, Se [2, 3].
Проведенные нами эксперименты по изучению особенности антиоксидантной защиты в слизистой оболочке щеки крыс после воздействия на них излучения эрбиевого лазера показали, что во все сроки заживления раны содержание Cu/Zn-СОД и активность СОД существенно не отличались как от значений животных контрольной группы, так и группы животных, которым деэпителизацию проводили скальпелем. Полученные результаты позволили сделать вывод, что в ране слизистой оболочки щеки крыс, независимо от способа ее нанесения, системы генерации свободных радикалов и антиоксидантной защиты в клетках эпителия находятся в динамическом равновесии.
Восстановление и замещение поврежденных тканей начинается формирования фибробластического барьера. Хемотаксис, активация и пролиферация фибробластов осуществляются под воздействием факторов роста фибробластов, тромбоцитов, ?-трансформирующего, некроза опухоли, интерлейкина-1?, а также кининов, тромбина и других регуляторных белков и пептидов. Слаженное взаимодействие регуляторных пептидов в зоне раневого дефекта в конечном итоге заканчивается формированием репарационного рубца.
Наши исследования показали, что в области раны слизистой оболочки щеки крыс, сформированной излучением эрбиевого лазера, на 2-е сутки наблюдался активный всплеск синтеза оФРФ-?, который сохранялся и на 3-и сутки заживления раны (табл. № 4).
Таблица № 5. Показатели смешанной слюны до и после операции оперкулэктомии в динамике заживления раны.
Группы |
Контрольная |
I-ая (n=25) |
II-ая (n=27) |
||||
Показатели |
До |
После |
До |
После |
|||
| 1 д. | 3 д. | 1 д. | 3 д. | ||||
| СРБ (мг/л) | 0 | 0,36±0,02
** |
0 | 0 | 0,38±0,04
** |
0,03±0,005 ** |
0 |
| Нсу
(мкмоль/л) |
0 | 0,26±0,07
** |
0 | 0 | 0,30±0,06
** |
0,62±0,04
** |
0,47±0,09
** |
| ФНО-?
(пг/мл) |
8,09±2,42 | 27,3±4,56
* |
23,2±4,29
* |
7,12±1,23
|
28,2±5,78
* |
57,8±12,6
* |
16,3±4,94
* |
| Аннексин V
(нг/мл) |
1,50±0,48 | 2,60±0,12
* |
4,11±0,51
** |
1,81±0,44
|
2,54±0,37
* |
4,33±0,32
** |
4,05±0,65
** |
| ?-Дефензины (нг/мл) | 1074±40,1 | 1136±12,9
* |
1097±26,1 | 1075±21,2
|
1133±16,3
* |
1101±48,1 | 1093±12,6 |
| Лактоферрин (нг/мл) | 7,54±0,30 | 36,6±3,45
** |
14,5±1,45
** |
8,14±1,20
|
40,6±1,88
** |
18,9±1,68
** |
9,56±0,35
|
| Ig A (мг/дл) | 425±87,1 | 388±45,6
** |
654±101
** |
436±77,3
|
397±56,7
** |
735±113
** |
613±91,4
** |
| IgG (мг/дл) | 0,32±0,05 | 336±87,4
** |
7,65±0,43
** |
0,41±0,05
|
367±94,9
** |
304±23,5
** |
26,7±3,87
** |
| IgM (мг/дл) | 253±65,8 | 509±119
* |
323±34,7
* |
245±56,3
|
513±78,1
* |
359±66,4
* |
345±54,0
* |
| oФРФ-?
(нг/мл) |
1,32±0,56 | 0,67±0,17
* |
0,96±0,21
* |
1,17±0,05
* |
0,65±0,08
* |
0,72±0,05
* |
0,88±0,07
* |
| OPG (пг/мл) | 0,28±0,05 | 0,94±0,06
** |
0,78±0,06
** |
0,32±0,03
|
0,88±0,05
** |
0 | 0,09±0,002
** |
| sRANKL
(пмоль/л) |
0 | 1,58±0,23
** |
0 | 0 | 1,63±0,43
** |
29,1±9,87
** |
1,13±0,22
** |
Достоверность различий при *р<0,05;**р<0,001 по сравнению с контрольной группой.
Уже на 5-е сутки количество оФРФ-? было сопоставимо с данными контроля, что свидетельствует о завершении эпителизации раневой поверхности в эти сроки. Полученные результаты отражают быстрое протекание фазы грануляции после воздействия лазера, в то время как после нанесения раны режущим инструментом длительность образований грануляций составила от 2 до 5 суток и только на 7-е сутки количество оФРФ-? как после воздействия лазера, так и скальпеля приближалось к значениям контрольной группы.
Пролиферативная фаза заживления раны характеризуется разрастанием соединительнотканного матрикса, которое регулируется интерлейкином–1?. Этот цитокин также контролирует активность матриксной металлопротеиназы-1 (ММП-1), участвующей в разрушении белковых компонентов межклеточного матрикса [7, 9].
В условиях нормы в тканях содержится незначительное количество активных ММП и их активность зависит от присутствия тканевых белковых ингибиторов (ТИМП) в окружающей среде. В живом организме для поддержания гомеостаза соблюдается четкое равновесие между активаторами протеолиза и их ингибиторами [2, 3]. Это позволяет рассматривать протеиназы не только в качестве деструктивных ферментов, обеспечивающих катаболизм белков и образование пептидов и аминокислот, но и основных участников регуляторных процессов, отвечающих за сохранность клеточного протеома.
В раневом дефекте, вызванном излучением эрбиевого лазера, на 2-е сутки заживления раны наблюдается увеличение количества проММП-1 и ТИМП-1 на фоне роста количества ИЛ-1? и ИЛ-6, которые постепенно снижаютсяв последующие сроки, что значительно отличается от показателей, полученных при нанесении раны скальпелем.
Выявленные изменения в системе протеиназа-ингибитор совпадают с данными морфологических исследований, показывающих, что после воздействия эрбиевого лазера на ранних этапах заживления дефекта наблюдается оптимальное очищение раны и течение репаративных процессов. Таким образом, заживление раны, нанесенной на слизистую оболочку щеки лазером, происходит быстрее, чем аналогичное заживление раны, нанесенной скальпелем.
В условиях нормы в тканях содержится незначительное количество активных ММП и их активность зависит от присутствия тканевых белковых ингибиторов (ТИМП) в окружающей среде
Это совпадает с результатами клинических исследований. Объективная оценка раневого процесса показала, что после нанесения раны скальпелем фибропластические процессы минимальны в течение первых 4—6 суток и сопровождались сосудистой и воспалительной реакцией. В хирургической ране, сформированной скальпелем, в первые сутки наблюдалась гиперемия и повышение местной температуры вследствие вазодилятации сосудов, коллатеральный отек, обусловленный повышенной сосудистой проницаемостью. Повышение внутритканевого давления сопровождается выраженным болевым синдромом, требующим приема обезболивающих препаратов в течение 4,5±0,5 суток.
Все пациенты, у которых применяли лазер, отмечали безболезненность процедуры, минимальный дискомфорт, удовлетворительное общее состояние во время операции и впоследующие дни послеоперационного периода. Лазерные операции проходили с меньшей травматизацией и кровопотерей.
Работа лазером в бесконтактном режиме или с легким касательным контактом сапфирового фибера с тканью исключала возможность оказывать давление на ткани. В послеоперационном периоде в основном отмечали слабовыраженный болевой синдром на протяжении 2,0±0,5 суток, который не требовал приема обезболивающих препаратов. Вероятно, это связано с меньшей травматизацией тканей и отсутствием компрессии нервных окончаний в области раны.
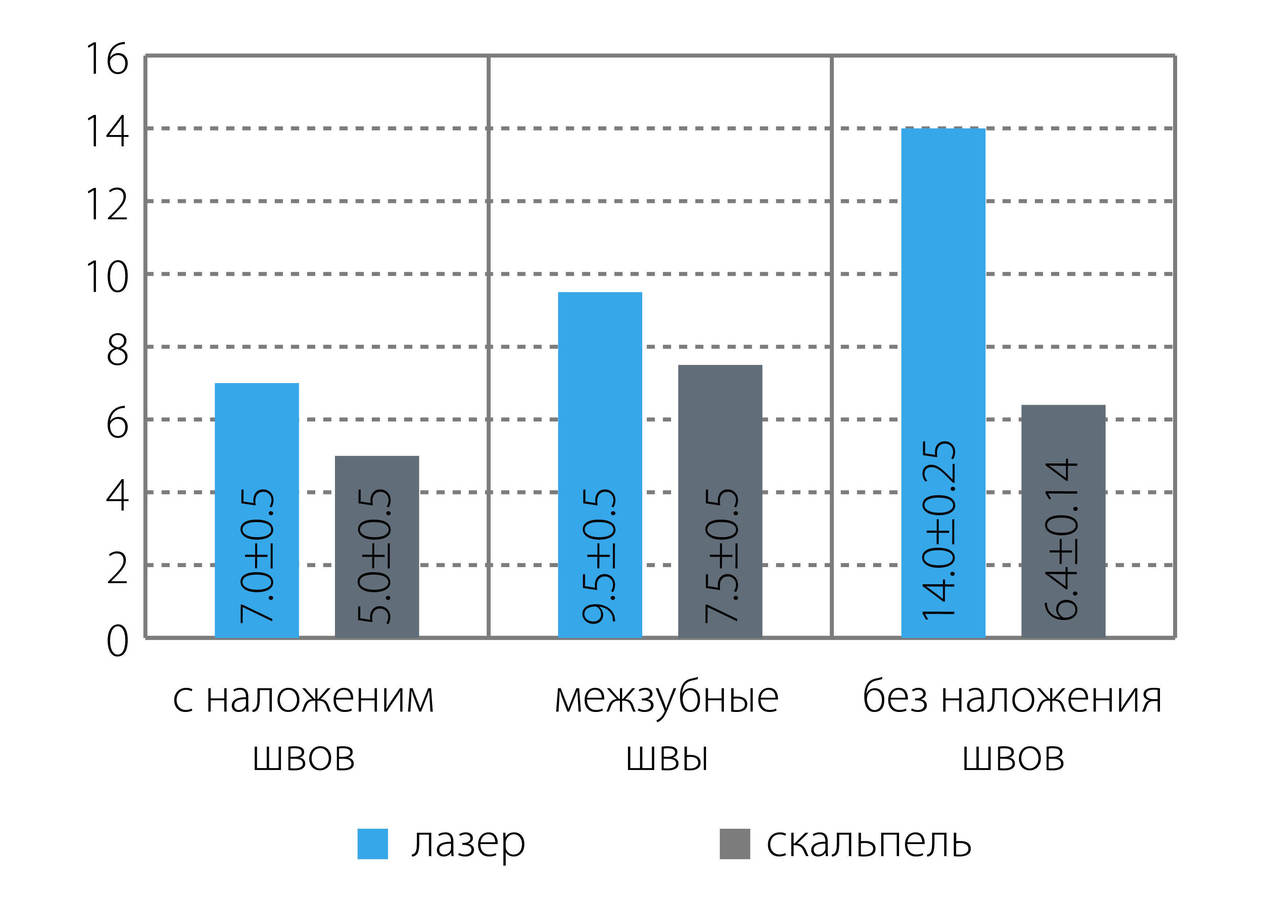
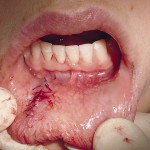
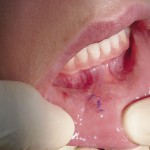
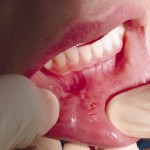
После проведения операции в зависимости от способа хирургического лечения у пациентов были выявлены достоверные различия по срокам и характеру заживления операционной раны. В результате воздействия эрбиевого лазера у пациентов, у которых на рану были наложены швы, рана зажила первичным натяжением на 5,0+0,5 сутки (рис. 5).
Послеоперационный рубец через 3 месяца представлял собой плоскую тонкую светлую полоску, по чувствительностии эластичности не отличался от окружающих неповрежденных тканей. Через 6 и 12 месяцев состояние рубца не изменялось. При проведении операции традиционным методом заживление наблюдали на 7,5+0,5 сутки. Послеоперационный рубец окончательно формировался только к 6-му месяцу (рис. 6).
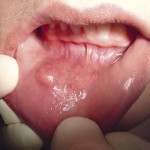
- Рис. 6а. Ретенционная киста нижней губы.
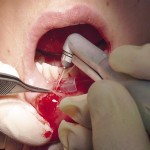
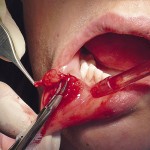
- Рис. 6б. Иссечение кисты эрбиевым лазером.
- Рис. 6в. Киста удалена целиком.
- Рис. 6г. Лазерное иссечение ретенционной кисты: вид послеоперационной раны.
- Рис. 6д. Лазерное иссечение ретенционной кисты нижней губы: рана ушита «на себя».
- Рис. 6е. Лазерное иссечение ретенционной кисты нижней губы — вид раны на 7-е сутки перед снятием швов.
- Рис. 6ж. Лазерное иссечение ретенционной кисты нижней губы: рана на 7-е сутки после снятия швов.
При проведении операций без наложения швов скальпелем операционная рана заживала вторичным натяжением с образованием на третий день грануляционной ткани под йодоформным тампоном, фиксированным к раневой поверхности швами. К пятому дню молодая грануляционная ткань полностью покрывала раневую поверхность. С этого времени рану вели открытым способом, без йодоформного тампона. На 14,0±0,25 сутки рана была покрыта молодой соединительной тканью:с прогрессированием раневого заживления грануляционная ткань трансформируется в аваскулярный и бесклеточный коллагеновый матрикс — рубец (рис. 5, 7).
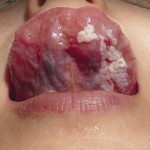
- Рис. 7а. Лазерное иссечение участков пораженной веррукозной формой лейкоплакии слизистой оболочки нижней поверхности языка: вид до операции.
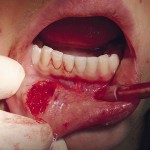
- Рис. 7б. Лазерное иссечение участков пораженной веррукозной формой лейкоплакии слизистой оболочки нижней поверхности языка: иссечение эрбиевым лазером.
- Рис. 7в. Лазерное иссечение участков пораженной веррукозной формой лейкоплакии слизистой оболочки нижней поверхности языка: формирование коагуляционного слоя на раневой поверхности.
- Рис. 7г. Лазерное иссечение участков пораженной веррукозной формой лейкоплакии слизистой оболочки нижней поверхности языка: рана полностью эпителизирована.
Через 30 дней при осмотре выявлялось начало формирования послеоперационных рубцов фиброзного характера, которые по мере созревания становились мягкими и эластичными лишь к 6-му месяцу.
При использовании эрбиевого лазера после формирования коагуляционной пленки на ране на следующие сутки она трансформировалась в фибринозную пленку, под которой проходила эпителизация без формирования грануляций по типу заживления под струпом. Постепенно зона фибринозной пленки сокращалась, наблюдалась краевая эпителизация, на 6,5±0,25 сутки полностью эпителизировалась. Покрытие раны коагуляционной, а затем фибринозной пленкой обеспечивает достаточную ее гидратацию в период эпителизации, в результате чего имела место более быстрая миграция эпителиальных клеток. При этом не изменялась архитектоника восстановленных тканей, а образованный рубец имел эластичную и мягкую консистенцию.
Покрытие раны коагуляционной, а затем фибринозной пленкой обеспечивает достаточную ее гидратацию в период эпителизации, в результате чего имеет место более быстрая миграция эпителиальных клеток
Мы предположили, что подробное раскрытие механизмов заживления раны после повреждения путем использования лабораторных методов исследования жидкостей полости рта, которые содержат продукты раневого транссудата, позволит переключаться с эмпирических подходов на доказательные. В качестве исследовательской модели нами была использована смешанная слюна и смывы со слизистой оболочки полости рта. Смешанная слюна, выделяясь из секреторных отделов малых и больших слюнных желез, поддерживает гомеостаз тканей полости рта. Поэтому в смешанной слюне пациентов были изучены изменения в содержании ряда белков, участвующих в местных воспалительных, антибактериальных и иммунных ответах, которые отражают не только патологическое состояние тканей, но и их реакцию в ответ на хирургическое вмешательство.
Анализ показателей биологических жидкостей пациентов с заболеваниями челюстно-лицевой области после хирургического лечения также показал преимущества лазерных технологий лечения. Проводимое комплексное хирургическое лечение хронического генерализованного пародонтита среднетяжелой степени с использованием излучения эрбиевого лазера способствует стабилизации мембран клеток пародонта после повреждения, о чем свидетельствует снижение через 6 месяцев количества Cu/Zn-СОД и активности общей СОД в слюне до значений лиц контрольной группы.
Применение лазерных технологий для хирургического лечения воспалительных заболеваний обеспечивает противовоспалительное действие и восстановление защитных систем полости рта,выражающееся в исчезновении в смешанной слюне С-реактивного белка, гомоцистеина, нормализации количества фактора роста фибробластов-?, аннексинаV, фактора некроза опухоли-? (ФНО-?), ?-дефензинов, лактоферрина, иммуноглобулинов А, G и M (табл. № 6).
Таблица № 6. Показатели иммунного статуса полости рта пациентов с воспалительными заболеваниями челюстно-лицевой области в динамике лечения.
Параметры |
До |
На 3-и сутки |
На 7-е сутки |
На 30-е сутки |
Норма |
|||
| Лазер | Традиц. | Лазер | Традиц. | Лазер | Традиц. | |||
| S-IgA, мг% (слюна) | 21,4±2,0 | 34,0+,0* | 14,0+,0** | 36,0+,0* | 19,4+,5* | 28,0+,5 | 22,0+,0 | 26,5±2,6 |
| IgG мг% (слюна) | 14,0±1,5 | 13,0+.2 | 15,6+,2 | 13,2+,1 | 14,1+,1 | 12,7+,0 | 13,0+,2 | 13,1±1,1 |
| IgA, мг% (слюна) | 12,6±1,1 | 11,0+,1 | 15,0+,1 | 10,1+,0 | 12,8+,6 | 10,4+,0 | 11,5+,0 | 10,2±1,1 |
| Лимфоциты (смыв), % | 1,2±0,1** | 6,1+,3** | 0,5+,03** | 4,0+,2** | 1,0+,07** | 2,1+,1** | 1,2+,09* | 2,0±0,1 |
| ФИ, % | 68,0±6,0 | 86,0+,0 | 50,3+,1** | 88,0+,0 | 52,0+,0** | 86,0+,0 | 67,0+,0 | 76,0±5,1 |
| ФЧ | 6,7±0,5 | 10,3+,0* | 4,0+,4** | 11,0+,0** | 7,1+,6 | 9,0+,7 | 7,5+,7 | 8,1±0,6 |
| EN-PO,% | 53,0±4,0 | 59,2+,0 | 41,0+,9** | 61,4+6,0 | 52,0+,0 | 58,0+,0 | 53,1+,0 | 58,2±4,0 |
| ДРОН, % | 31,0±1,5 | 36,0+,0 | 27,0+,5* | 40,0+,0* | 32,0+,3 | 39,0+,0 | 33,0+,0 | 32,5±1,7 |
| S-IgA/IgG | 1,5±0,009** | 2,6+,20** | 0,90+,07** | 2,70+,20** | 1,40+,06** | 2,20+,15 | 1,70+0,10* | 2,0±0,1 |
| S-IgA/IgA | 1.65±0,15** | 3,00+,25 | 0,93+,07** | 3,56+,30** | 1,5+,10** | 2,69+,20 | 1,90+,11** | 2,6±0,15 |
| IgG/ФЧ | 2,1±0,15* | 1,26+,1 | 3,9+,3** | 1,2+,1 | 2,0+,2 | 1,4+,15 | 1,7+,1** | 1,6±0,1 |
Достоверность различий при **p<0,001; *p<0,05 до и после операции.
Степень развития локальной воспалительной реакции в полости рта отражает содержание ФНО-?, который участвует не только в защитных реакциях, но и в процессах деструкции и репарации, сопутствующих воспалению. Использование эрбиевого лазера приводило к снижению содержания ФНО-? в слюне уже на 1-е сутки регенерации раны, а на 3-и сутки не отличалось от значений контрольной группы. В случае применения стандартных хирургических инструментов уровень ФНО-? в слюне оставался достоверно высоким, что свидетельствует о сохраняющемся воспалении. ФНО-? также принимает активное участие в резорбции кости.
Также маркером воспалительной реакции является С-реактивный белок, который в слюне в норме не выявлялся. Однако у пациентов, которым иссекали нависающую слизистую оболочку скальпелем, содержание С-реактивногобелка в слюне сохранялось до 3 суток заживления раны.
Применение лазерных технологий для хирургического лечения воспалительных заболеваний обеспечивает противовоспалительное действие и восстановление защитных систем полости рта
Информативным показателем деструкции костной ткани пародонта в смешанной слюне является исследование содержания остеопротегерина (OPG) и растворимого рецептора лиганда ядерного фактора каппа В (sRANKL). При развитии патологического пути регенерации в пародонте возникает дисбаланс в остеокласт/остеобласт активирующей системе, которая в норме обеспечивает процесс ремоделирования костной ткани. Согласно полученным нами данным, в норме в слюне не определяется содержание sRANKL, но развитие перикоронита сопровождается появлением в смешанной слюне sRANKL и повышением содержания OPG.
Оперкулэктомия с использованием эрбиевого лазера в динамике заживления раны приводила к исчезновению в смешанной слюне пациентов sRANKLи снижению количестваOPG до значений контрольной группы. Использование режущего инструмента характеризовалось процессами, смещенными в сторону резорбции костной ткани альвеолярного отростка, проявляясь в повышенном количестве sRANKL.Известно, что на синтезsRANKL влияют клетки моноцит-макрофагальной линии, которые инициируют синтез мРНКsRANKL в остеокластах и подавляют синтез мРНКOPG в остеобластах.
Нами были изучены лазер-индуцированные изменения общего и местного иммунитета при воздействии излучения эрбиевого лазера на ткани полости рта. После традиционного хирургического лечения пациентов с воспалительными заболеваниями челюстно-лицевой области популяционный состав лейкоцитов в периферической крови изменился в сторону снижения относительного числа найтрофилов, индекса интоксикации и увеличения относительного количества лимфоцитов, что указывает на уменьшение активности воспалительного процесса и иммунодефицита. Показатели местной реактивности в полости рта не достигают нормальных величин, что создает возможность развития послеоперационных осложнений.
Удобство клинического применения лазерных технологий, атравматичность, обезболивающий и гемостатический эффект, регенерирующее действие и улучшение микроциркуляции позволяют сократить время оперативного вмешательства и сроки заживления
По нашим данным, применение излучения эрбиевого лазера нормализует секреторные, гуморальные и клеточные факторы местной защиты и полностью восстанавливает нарушенные между ними взаимосвязи. Популяционный состав лейкоцитов в периферической крови указывает на стихание фазы воспаления и, соответственно, развитие интоксикации и иммунодефицита. Отмечается также лазер-индуцированная стимуляция ЭБ- и fac-рецепторов нейтрофилов, что стимулирует фагоцитарный процесс выше нормальных показателей. После воздействия эрбиевого лазера наблюдается приток в полость рта из крови иммунокомпетентных В-лимфоцитов, а также стимуляция продукции S-компонента эпителиальными клетками слизистой оболочки полости рта, что приводит к увеличению количества секреторного иммуноглобулина А.
Таким образом, по нашим данным, наилучшие результаты были получены у пациентов, у которых для хирургического лечения заболеваний челюстно-лицевой области применяли лазерные технологии. Удобство клинического применения, атравматичность, обезболивающий и гемостатический эффект, регенерирующее действие и улучшение микроциркуляции позволили сократить время оперативного вмешательства и сроки заживления. Излучение эрбиевого лазера восстанавливает структуру клеточных мембран тканей полости рта в более короткие сроки, усиливает местный тканевый иммунитет и ангиогенез, стимулирует регенерацию всех тканей пародонта, включая и костную.
Список литературы находится в редакции.