РЕАБИЛИТАЦИЯ ПАЦИЕНТА С ВЫРАЖЕННОЙ АТРОФИЕЙ АЛЬВЕОЛЯРНОГО ОТРОСТКА ВЕРХНЕЙ ЧЕЛЮСТИ С ИСПОЛЬЗОВАНИЕМ КОСТНЫХ БЛОЧНЫХ АУТОТРАНСПЛАНТАТОВ И НЕМЕДЛЕННОЙ УСТАНОВКОЙ ИМПЛАНТАТОВ С ГДС
О. С. Ковтуняк
челюстно-лицевой хирург высшей категории ЧП «Эстетик Дент», Член Ассоциации имплантологов Украины, г.Львов, Украина
М. И. Миняйло
стоматолог-хирург высшей категории, главный врач стоматологического центра «Dent Art Studio», Член Ассоциации имплантологов Украины, г.Донецк, Украина
Б. С. Козлов
магистр медицинских наук, ассистент кафедры ортопедической стоматологии Донецкого национального медицинского университета им.М.Горького, Член Ассоциации имплантологов Украины, г.Донецк, Украина
При проведении имплантации непосредственно либо отсроченно (через 3—4 мес.) после удаления зуба в большинстве случаев имеются все условия для успешной инсталляции и последующей остеоинтеграции внутрикостных имплантатов [1—3]. Согласно индексу Лекхольма и Зарба (Lekholm & Zarb, 1985), при давней адентии качество кости часто относится к 4-му типу, а количество ее соответствует критериям качества D или Е [4, 5]. Это существенно снижает возможность применения внутрикостных имплантатов из-за высокой степени вероятности повреждения нижнелуночкового нерва, пенетрации слизистой оболочки дна верхнечелюстной пазухи и других анатомических образований [5].
Таким образом, в условиях выраженной атрофии альвеолярных отростков, что наблюдается обычно при давней адентии, бывает трудно, а иногда невозможно проведение стоматологического лечения пациентов с использованием дентальных имплантатов. Поэтому проблема восстановления толщины и высоты альвеолярного отростка в области адентии актуальна сегодня и применение реконструктивных методик необходимо и оправданно, несмотря на их относительную травматичность.
Возможно несколько основных хирургических подходов [6, 7]:
-
резекция гребня альвеолярного отростка до уровня достаточной его толщины (при достаточной высоте костной ткани в месте имплантации (преобладание вертикальной атрофии);
-
проведение синус-лифта с непосредственной либо отдаленной имплантацией;
-
расщепление альвеолярного отростка;
-
различные дистракционные техники;
-
проведение имплантации с восстановлением недостающего объема кости остеопластическим материалом и перекрытием мембраной (не всегда обеспечивает достаточную стабилизацию, если не сохранена какая-либо стенка альвеолярного отростка);
-
костная пластика с использованием различных блочных трансплантатов. Как правило, используются небольшие по объему аутотрансплантаты, содержащие преимущественно компактный слой костной ткани, — так называемые монокортикальные костные блоки.
Аугментация аутогенного блочного трансплантата представляет собой один из наиболее надежных и эффективных методов регенерации костных тканей на достаточно протяженных участках [8, 9]. Такие трансплантаты обладают высоким остеогенным потенциалом. В них наблюдают наиболее раннюю васкуляризацию (Архипов Б. Д. и соавт., 1985). Это можно объяснить тем, что при их трансплантации в полость дефекта вносятся аутогенные остеоиндуктивные клетки и факторы роста [7].
В литературе имеются данные об установке имплантатов как непосредственно во время трансплантации костных блоков (Breine & Branemark, 1980; Adell et al, 1990; Isacksson & Alberius, 1992), так и поэтапно после костной реконструкции атрофированных челюстей (Blomgvist et al, 1998; Jensen & Sennerby, 1998; Lundgren et al, 1999). Использование костных блоков позволяет не проводить операцию синус-лифтинга в области их установки.
Необходимы установка «трофичного» трансплантата и обеспечение поддержки трофичности в дальнейшем. В этих целях следует достичь:
-
прилегания блока к губчатому веществу кости реципиентного ложа;
-
максимального перекрытия слизисто-надкостничным лоскутом;
-
при выборе донорской зоны следует отдавать предпочтение участкам челюсти, в которых наиболее выраженна губчатая кость (особенно важно при выделении моноблочных трансплантатов).
Чтобы блок не терял своих качеств, его до установки лучше оставлять в донорском ложе (в крови) либо в охлажденном физиологическом растворе (рис. 6). Трансплантат нельзя пересушивать, а при его выделении необходимо осуществлять обильное орошение для недопущения перегрева препарируемой кости.
По нашему мнению, наиболее стабильных результатов можно достичь, используя сочетание техники реконструкции альвеолярного отростка с помощью аутогенного костного трансплантата с немедленной установкой имплантата с горизонтально дистанцированным соединением (ГДС) и использованием остеопластических материалов и мембран (рис. 10—18).
- Рис. 10. Хирургическая картина после заполнения образовавшегося пространства в гайморовой пазухе до нового уровня слизистой выстилки костнопластическим материалом.
- Рис. 11. Костный блок непосредственно перед аугментацией на стерильной салфетке.
- Рис. 12. Костный блочный аутотрансплантат установлен в ретенционное ложе.
- Рис. 13. В костный блок установлен имплантат.
- Рис. 14а. Формирование костных лож в альвеолярном отростке слева ручным инструментом.
- Рис. 14б. Формирование костных лож в альвеолярном отростке слева ручным инструментом.
- Рис. 15. Немедленно установленные имплантаты на верхней челюсти справа.
- Рис. 16. Временные имплантаты установлены в промежутках между перманентными имплантатами.
- Рис. 17. Область аугментации трансплантата и костного биозаменителя перекрыта резорбируемой мембраной.
Сочетание различных реконструктивных методик кумулирует в себе как положительные, так и отрицательные качества каждой составляющей методики. Тем не менее комбинированные подходы более целесообразны, поскольку при правильном сочетании объединяют в себе положительные стороны составных методик, что максимально снижает риск возникновения осложнений в послеоперационном периоде и повышает их эффективность.
Аугментация костных трансплантатов позволяет создать вокруг имплантата необходимую толщину костной ткани. При ее проведении следует учитывать послеоперационную резорбцию кости над платформой имплантата (в случае применения имплантатов с «прямым» соединением между абатментом и телом) [7, 8]. Во избежание возможной потери эстетики вследствие этого необходима глубокая субповерхностная установка имплантатов (по сравнению с проведением имплантации в обычных условиях). При немедленной трансблочной имплантации установленный имплантат обеспечивает дополнительную стабилизацию костного блока и поликортикальную фиксацию имплантатов. В противном случае не будет компенсирован пришеечный остеолизис и может произойти оголение различных структур имплантата. Для того чтобы этого не происходило, соотношение высоты блока и его диаметра должно находиться в максимальном приближении к 1:1. Необходимо также стараться выделить такой трансплантат, чтобы в случае немедленной трансблочной установки имплантата его внутрикостную часть окружала костная ткань, по ширине равная диаметру устанавливаемого имплантата. Поскольку формирование таких трансплантатов не всегда возможно, возникает необходимость дополнительного внесения по их периметру остеопластического материала в виде гранул или хлопьев.
Многие проблемы, связанные с неприживлением костных блоков, возникают именно из-за использования трансплантатов недостаточного объема и в ряде случаев с недостаточной трофичностью трансплантатов. Проблемы с трофикой могут быть связаны как с индивидуальными анатомическими особенностями пациента, так и с низкой скоростью реваскуляризации самого трансплантата при остальных нормальных условиях. В связи с этим ряд авторов отмечает целесообразность выделения блочных трансплантатов без кортикального слоя (моноблочные губчатые трансплантаты). Ряд фирм выпускает специальные торцевые фрезы для ликвидации компактной кости. Эти инструменты соответствуют по диаметру трепанам, служащим для выделения блоков, что обеспечивает препарирование кортикальной кости четко в пределах границ трансплантата.
Можно выделить следующие положительные стороны данной концепции:
-
губчатый трансплантат быстрее и в большей степени реваскуляризируется по сравнению с бислойным (имеющим кортикальную пластинку) трансплантатом;
-
благодаря этому менее выраженна степень резорбции блочного монослойного трансплантата по сравнению с бислойным;
-
имеется возможность использования аутокостной стружки, полученной после снятия компактного слоя костной ткани.
Тем не менее использование бислойных трансплантатов с выраженным кортикальным слоем обеспечивает более жесткую фиксацию как самого трансплантата, так и внутрикостного имплантата. К недостаткам монослойных трансплантатов следует также отнести их меньший объем, а именно параметр высоты блока, в сравнении с бислойными.
Проблему относительно медленной реваскуляризации над бислойным блоком можно решить при достаточной его площади путем создания тонких вертикальных сверлений через компактную пластинку трансплантата, что обеспечит значительное увеличение контакта кости блока с кровью.
Немедленная установка имплантата сокращает сроки лечения, хотя уровень трофики может несколько снижаться вследствие того, что костный блок лишен кровоснабжения, характерного для челюстной кости. Поэтому имплантат желательно устанавливать несколько глубже 1 мм относительно поверхности кортикальной кости трансплантата. При этом чем меньше соотношение диаметра блока и его высоты, тем глубже необходимо установить имплантат.
Костный трансплантат по своим параметрам должен быть в высокой степени конгруэнтен своему ложу. Выпилить трансплантат можно с помощью различных инструментов (например, осциллирующей пилы, пьезоэлектрического скальпеля или более традиционного фиссурного бора на прямом наконечнике). Однако в случае замещения дефекта костной ткани в области одного зубо-альвеолярного фрагмента формировать их лучше всего с помощью цилиндрических трепанов (рис. 1). В таких клинических ситуациях наиболее целесообразно осуществлять забор трансплантата в межментальной области. Это обусловлено более легким доступом к данной области по сравнению с областью ветви челюсти, практически полным исключением возможности повреждения нижнечелюстного сосудисто-нервного пучка.
Необходимо уточнить, что переломы нижней челюсти, связанные с забором костного трансплантата, наблюдаются чрезвычайно редко как при вмешательстве в области ветви челюсти, так и в межментальном отделе. Возникновение данного осложнения наблюдается обычно в результате нанесения прямого удара в область забора трансплантата до заживления донорской зоны.
Разница в диаметре используемых трепанов должна компенсировать разницу наружного и внутреннего диаметра инструмента, то есть толщину его режущей стенки, что суммарно (обе стенки) составляет около 1 мм. Показателем того, что инструмент подобран правильно, является вхождение одного трепана в другой «с притиркой» (рис. 2а, б). При этом меньший из трепанов предназначен для формирования границ реципиентного ложа, а больший — для выделения блока. Именно такая комбинация диаметров инструментов обеспечит в последующем высокую степень конгруэнтности формы трансплантата сформированному костному ложу.
- Рис. 2а. Подбор трепанов для выделения костного блока и формирования ложа.
- Рис. 2б. Инструменты подобраны оптимально. Трепаны входят один в другой «с притиркой».
После формирования трепаном границ ложа при необходимости «срезается» верхушка гребня альвеолярного отростка в пределах, ограниченных инструментально, с целью создания по гребню альвеолярного отростка в области установки трансплантата площадки. Это делается для того, чтобы при позиционировании костного блока создавалась максимальная площадь контакта его с ложем (не менее 40 % поверхности трансплантата должно находиться в контакте с костью челюсти). Контакт осуществляется таким образом, что губчатая кость блока контактирует с ложем, а к полости рта обращена кортикальная пластинка трансплантата (при использовании аутотрансплантатов и трупного материала). В случае использования блоков искусственного происхождения не имеет значения, какой своей поверхностью блок будет ориентирован к поверхности реципиентного ложа.
Вследствие так называемой адаптационной атрофии на первом этапе остеоинтеграции блочный трансплантат, как правило, теряет часть первоначального объема, что может приводить к возникновению различных функциональных и эстетических проблем [10, 11].
По данным различных авторов, у пациентов, которым не проводилась немедленная имплантация, резорбции подвергается до 50 % костной ткани блока от первоначального его объема. Это можно объяснить нарушением трофики в области пересаженного трансплантата и недостаточной нагрузкой на костную ткань [12—14]. А. А. Кулаков отмечает основной объем потери аутокостного трансплантата вследствие его резорбции в период между 1-м и 2-м этапами имплантации (5—10 % объема при ношении съемной пластиночной ортопедической конструкции, 15—25 % за год без использования съемного протеза). В последующем резорбция костной ткани не превышает 3—5 % вследствие физиологической нагруженности альвеолярного гребня через дентальный имплантат.
Прочная фиксация трансплантата позволяет значительно снизить скорость протекания этого биологического процесса, а перекрытие поверхности трансплантата с помощью биозаменителей костной ткани и барьерных мембран практически полностью предотвращает его «оседание» [8]. Благодаря этому в большинстве случаев удается восстановить физиологическую анатомию альвеолярных отростков и создать оптимальные условия для регенерации окружающих мягких тканей [7, 9].
Для оптимизации кровоснабжения области, заполненной костным биозаменителем, возможна перфорация кортикальной пластинки, расположенной непосредственно под остеопластическим материалом. В случае истончения кортикальной кости по срединной оси имплантата такие перфорации можно выполнить по периферии проекции костного ложа имплантата (приблизительно в 5 мм от его тела).
При установке имплантата немедленно в костный блок его внутрикостная часть располагается минимум в двух слоях кортикальной кости (1-й слой — в костном блоке, 2-й — наружная кортикальная пластинка челюстной кости), а в ряде случаев возможно поликортикальное расположение имплантата (кортикальный слой блока и бикортикальное расположение в челюсти). Это способствует более надежной фиксации и стабилизации как блока, так и имплантата.
Осуществляемое при подобных вмешательствах более широкое отслоение слизисто-надкостничных лоскутов обеспечивает лучшую визуализацию операционного поля, а также условия для сведения краев раны без натяжения.
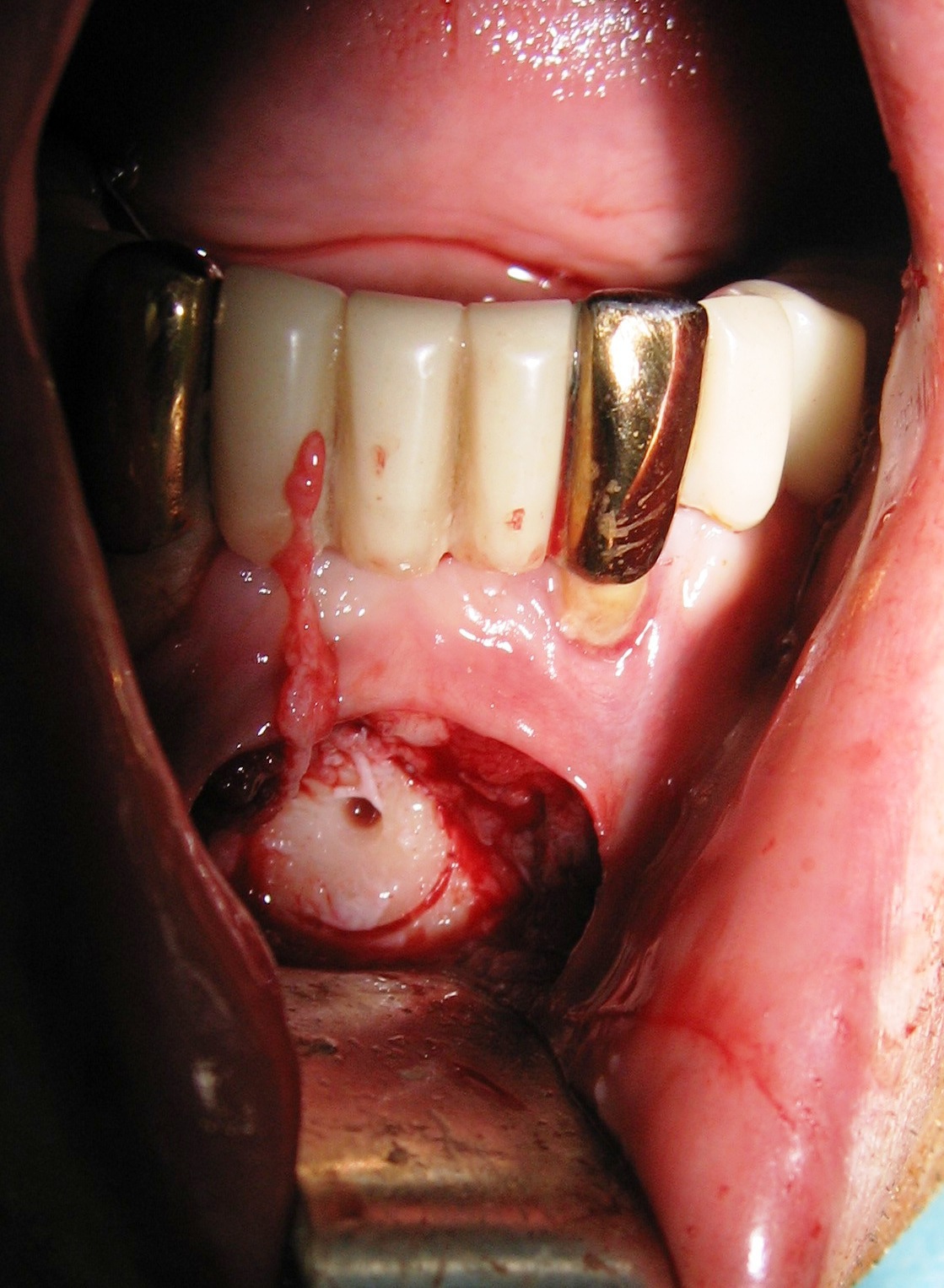
На клиническом примере пациента О., 48 лет, показан комплексный подход при реабилитации пациентов с выраженной атрофией альвеолярного отростка с использованием костных блочных аутотрансплантатов, техники НТР и немедленной установкой имплантатов с ГДС.
Ранее пациенту было проведено ортопедическое лечение с использованием металлопластмассовых мостовидных конструкций (рис. 3). На верхней челюсти был зафиксирован дуговой штампованно-паяный мостовидный протез с опорой на 17, 13, 11, 21 и 23-й зубы. В 13-м и 23-м зубах на рентгенологическом снимке определяются литые штифтовые конструкции с явной перфорацией корня 13-го зуба (рис. 4). Опорные коронки не имели плотного охвата шеек зубов, что подтверждено инструментальным и рентгенологическим исследованием. 24, 25, 26-й зубы были замещены консольной частью протеза, что привело к развитию локального травматического пародонтита 23-го зуба (определяется значительная потеря костной ткани с образованием пародонтального кармана).
- Рис. 3. Исходная клиническая ситуация (вид в полости рта).
- Рис. 4. Исходная клиническая ситуация (рентгенологический снимок).
- Рис. 5. Создание доступа в межментальной области для забора аутогенного костного блока.
На нижней челюсти был установлен штампованно-паяный мостовидный протез с пластмассовой облицовкой в области промежуточных частей. Опорные коронки не имели облицовки и не отвечали требованиям к краевому герметизму (рис. 4, 5). Несмотря на отсутствие явной подвижности ортопедической конструкции в полости рта, по рентгенологическому снимку определялась характерная перегрузка опорных зубов во фронтальном отделе челюсти (рис. 4).
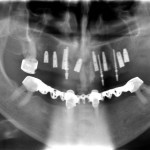
При анализе панорамного рентгенологического снимка было дополнительно определено следующее. В области моляров с обеих сторон верхней челюсти наблюдалась недостаточная высота альвеолярного отростка для установки имплантатов по классической методике. На нижней челюсти на протяжении всего альвеолярного отростка определялись благоприятные условия для проведения внутрикостной имплантации.
На основании полученных данных был составлен план лечения. Согласно нему реабилитационные мероприятия было решено разделить на 3 этапа.
1-й этап:
-
снятие имеющейся ортопедической конструкции на верхней челюсти;
-
удаление 13-го и 23-го зубов;
-
одновременное проведение двустороннего синус-лифтинга с установкой аутокостного трансплантата в области 23-го зуба и немедленной инсталляцией постоянных и временных имплантатов, в том числе одного трансблочно;
-
перекрытие области синус-лифтинга и установка аутотрансплантата резорбируемыми мембранами;
-
изготовление временного съемного мостовидного металлопластмассового протеза с литым каркасом с опорой на временные имплантаты и 17, 11 и 21-й зубы.
На время интеграции имплантатов и до завершения всех репаративных процессов на верхней челюсти мостовидный протез на нижней челюсти было решено не ликвидировать. В комплексе с временной ортопедической конструкцией верхней челюсти он фиксировал высоту прикуса и обеспечивал некоторую окклюзионную разгрузку опорных элементов на верхней челюсти за счет максимально уменьшенной площади жевательной поверхности (клинически обусловленная необходимость предыдущего лечения).
2-й этап:
-
установка абатментов на постоянные имплантаты верхней челюсти;
-
удаление временных имплантатов;
-
одновременное снятие ортопедической конструкции на нижней челюсти с удалением 32-го и 42-го зубов и инсталляцией 8 одноэтапных имплантатов (по 3 в области жевательных зубов с каждой стороны и 2 в лунки удаленных зубов);
-
изготовление провизорных ортопедических конструкций.
3-й этап: протезирование постоянными ортопедическими конструкциями.
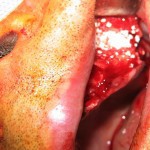
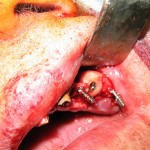
Перед непосредственным оперативным вмешательством были проведены антисептическая обработка операционного поля, соответствующая премедикация и анестезия. Блок был выделен по классической методике в межментальном пространстве (рис. 5—7).
До момента трансплантации в подготовленное ложе блок находился в донорской зоне.
Образовавшаяся костная полость после извлечения трансплантата регенерирует самостоятельно в условиях отсутствия патологического воздействия различной этиологии и адекватного заживления операционной раны.
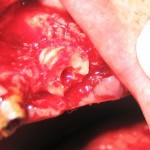
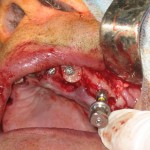
Следующим этапом после формирования костного блока были осуществление доступа, формирование реципиентного ложа для трансплантата и проведение синус-лифтинга (рис. 8—10).
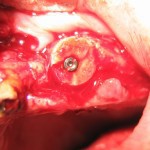
Костная рана перед установкой трансплантата была «освежена», чтобы все пространство между поверхностями блока, прилегающими к ложу, было заполнено свежей кровью, после чего был установлен подготовленный трансплантат (рис. 11, 12). Перед извлечением блока из донорской зоны в нем был сформирован канал для прохождения имплантата заранее определенного диаметра.
Непосредственно после аугментации костного блока была проведена немедленная транс блочная установка имплантата (рис. 13). Он имел контакт как с костью блока, так и с костной тканью альвеолярного отростка.
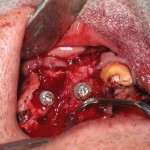
Затем в области проведенного синус-лифтинга слева и справа были сформированы ложа для немедленной установки имплантатов в области моляров (рис. 14, 15). Ввиду низкого качества челюстной кости в области устанавливаемых имплантатов костное ложе формировалось с использованием специальных разверток по мануальному протоколу для кости низкой плотности.
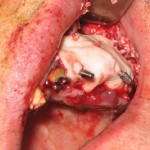
На время остеоинтеграции постоянных имплантатов и репаративных процессов в области реконструктивного вмешательства были установлены временные имплантаты для фиксации провизорной ортопедической конструкции (рис. 16). Затем операционная поверхность была перекрыта резорбируемой мембраной (рис. 17), а операционная рана после этого глухо ушита.
На рентгенологическом снимке видно оптимальное позиционирование костного блока. Он имеет плотный контакт с ложем. Установленный трансблочно имплантат 2/3 своей поверхности контактирует с костью челюсти и 1/3 с трансплантатом. Постоянные имплантаты установлены на достаточном расстоянии друг от друга, что дало возможность дополнительно разместить временные имплантаты в межимплантатных промежутках. Четко прослеживается граница поднятия дна гайморовой пазухи. Отсутствие следов остеопластического материала в просвете верхнечелюстного синуса свидетельствует об отсутствии перфорации Шнайдеровской мембраны (рис. 18).
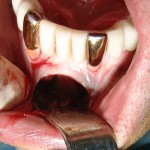
В последующем был изготовлен временный съемный мостовидный протез с литым каркасом, который имел опору как на естественные оставшиеся зубы, так и на временные имплантаты. В области 18-го зуба имеется удерживающий кламмер, что значительно повысило стабильность протеза в сагиттально-трансверсальной плоскости. Конструкция надежно защищала область разреза. Однако в последующем возникла необходимость удаления 21-го зуба и временного имплантата в промежутке между постоянными имплантатами в области 22-го и 24-го зубов. Во время ревизии зоны осложнения было принято решение об удалении также имплантата в области 22-го зуба в целях предотвращения нежелательной потери костной ткани. После удаления зуба и имплантата на верхней челюсти была проведена перебазировка временного протеза соответственно новым анатомическим условиям. Это способствовало его стабилизации и перераспределению жевательного давления. На время интеграции имплантатов на верхней челюсти имеющаяся ортопедическая конструкция на нижней челюсти не замещалась (рис. 19).
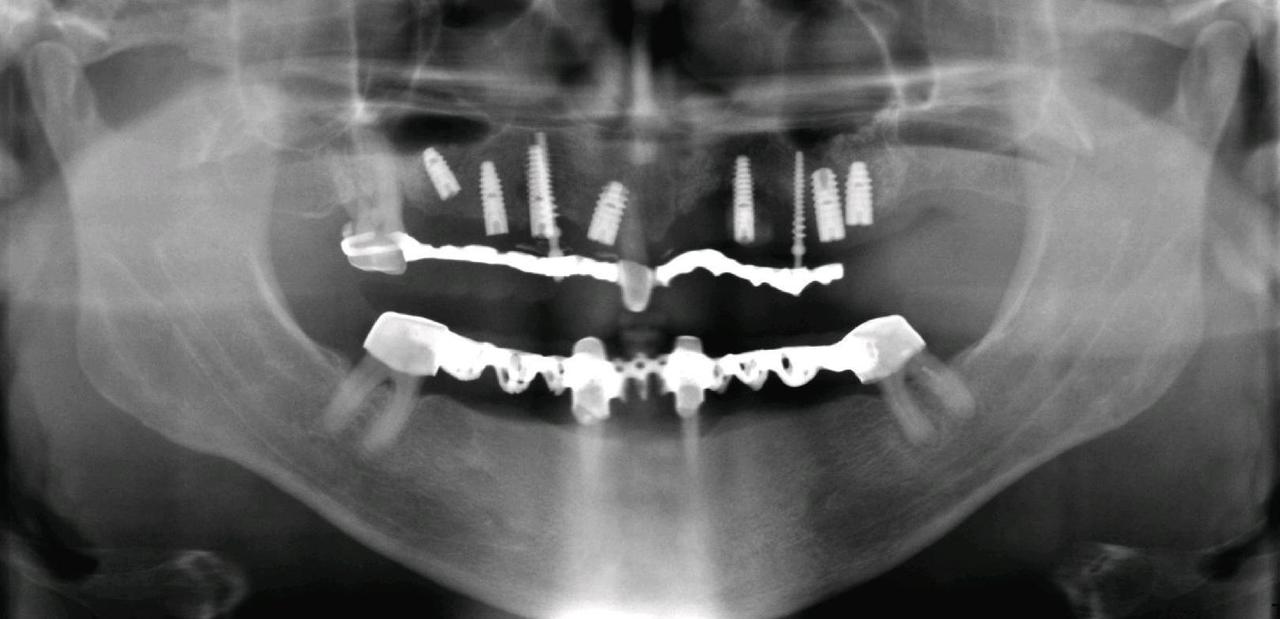
Рис. 19. Клиническая ситуация после удаления 21-го зуба, имплантата в области 22-го зуба и временного имплантата в области 23-го зуба с установленным временным мостовидным съемным протезом с литым каркасом.
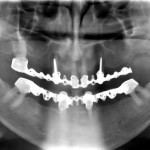
2-й этап. В связи с новыми клиническими условиями был изменен план лечения. Перед установкой абатментов решено провести повторную имплантацию в области 22-го зуба в целях создания достаточного количества опор для протезирования несъемной протетической конструкцией и установить неразборный резьбовой имплантат в области бугра верхней челюсти — опору для антагонирующего с нижним 37-м зубом искусственного зуба. После инсталляции дополнительных имплантатов установлены абатменты с предварительной установкой соосности (без проведения индивидуального фрезерования супраструктур) (рис. 20).
На нижней челюсти произведено снятие имевшейся ранее ортопедической конструкции с одновременным удалением латеральных резцов, сохранение которых в протетических целях в данном случае является нецелесообразным. Вслед за этим осуществлена одноэтапная имплантация 8 неразборных внутрикостных имплантатов — по 3 в области жевательной группы зубов с каждой стороны и 2 во фронтальном отделе челюсти.
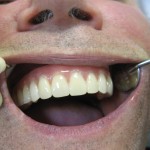
После проведения рентгенологического контроля ситуации в полости рта (рис. 20) осуществлена ортопедическая реабилитация пациента с использованием несъемных металлокерамических конструкций по общепринятому протоколу. Зубы пациента покрывались отдельно стоящими коронками.
Таким образом, протетический комплекс на верхней челюсти состоял из 4 ортопедических элементов (2 одиночные коронки с опорой на 17-й и 11-й зубы), а на нижней челюсти — из 3 ортопедических элементов (2 одиночные коронки с опорой на 37-й и 47-й зубы и 1 мостовидный протез с опорой на дентальные имплантаты).
Выводы
В сложных клинических ситуациях оптимальным является использование комбинированных подходов при реабилитации стоматологических больных. При рассмотрении представленного клинического случая было использовано 6 реконструктивных методик как элементов комбинированного реконструктивного вмешательства в области альвеолярного отростка челюсти:
-
Синус-лифтинг.
-
Аугментация аутокостного блочного трансплантата.
-
Заполнение поднутрений между трансплантатом и костью челюсти остеопластическим материалом.
-
Немедленная инсталляция имплантатов с ГДС на всем протяжении замещаемого дефекта зубного ряда, включая трансблочное расположение имплантата.
-
Установка временных имплантатов для протезирования провизорной ортопедической конструкцией.
-
Перекрытие области проведения пластики резорбируемой мембраной.
Несмотря на свою сложность, адекватно проведенное хирургическое вмешательство в комплексе с установкой имплантатов с ГДС позволяет получить стабильные и прогнозируемые результаты функциональной эстетики.