Хирургическая тактика при лечении «дезоморфиновых» остеонекрозов челюстей: секвестрэктомия или резекция?
А. А. Нестеров
к. м. н., доцент кафедры стоматологии и челюстно-лицевой хирургии Астраханской государственной медицинской академии
И. Н. Востриков
ассистент кафедры стоматологии и челюстно-лицевой хирургии Астраханской государственной медицинской академии
С. А. Батыров
ассистент кафедры стоматологии и челюстно-лицевой хирургии Астраханской государственной медицинской академии
По мере увеличения количества пролеченных больных, страдающих очаговыми или диффузными «дезоморфиновыми» остеонекрозами (остеомиелитами) челюстей, накапливаются данные о различных возможностях оперативного лечения этого заболевания. Ранее мы могли ориентироваться лишь на опыт зарубежных коллег из США и Западной Европы, где с начала 2000-х пролечено значительное количество пациентов с так называемыми бисфосфонарными остеонекрозами челюстей (БФОН).
Близкие по клинике и этиологии к «дезоморфиновым» остеонекрозам, БФОН являются осложнением терапии метастазов рака и системного остеопороза. Пациенты с БФОН — это социально адаптированные люди среднего и пожилого возраста с санированной полостью рта. Соответственно, приводимые в литературе данные о лечении больных с БФОН никак не соотносятся с реальными возможностями оказания помощи дезоморфиновым наркоманам. Сейчас можно говорить о собственных отдаленных результатах лечения «дезоморфиновых» остеонекрозов глубиной до 5 лет, сравнивая данные из клиник нескольких регионов Российской Федерации и Украины.
В отделении челюстно-лицевой хирургии Александро-Мариинской областной клинической больницы (г. Астрахань) с 2008 по 2013 год проведено хирургическое лечение 72 пациентам с очаговым и диффузным одонтогенным остеомиелитом челюстей на фоне наркотической зависимости от кустарного «дезоморфина». Возраст пациентов составил от 19 до 55 лет, из них 67 % мужчин и 33 % женщин. Изолированное поражение нижней челюсти отмечалось у 47 % пациентов, верхней челюсти — у 38 %, остеомиелит верхней и нижней челюстей наблюдался в 15 % случаев. У 2 пациентов имело место сочетание остеомиелита верхней челюсти, скуловой кости и крыловидного отростка клиновидной кости. Диффузное поражение челюстей мы наблюдали у 34 % пациентов, очаговое — у 66 %. За время лечения из числа прооперированных больных умерли от передозировки наркотических средств 2 человека, от септических осложнений — 1.
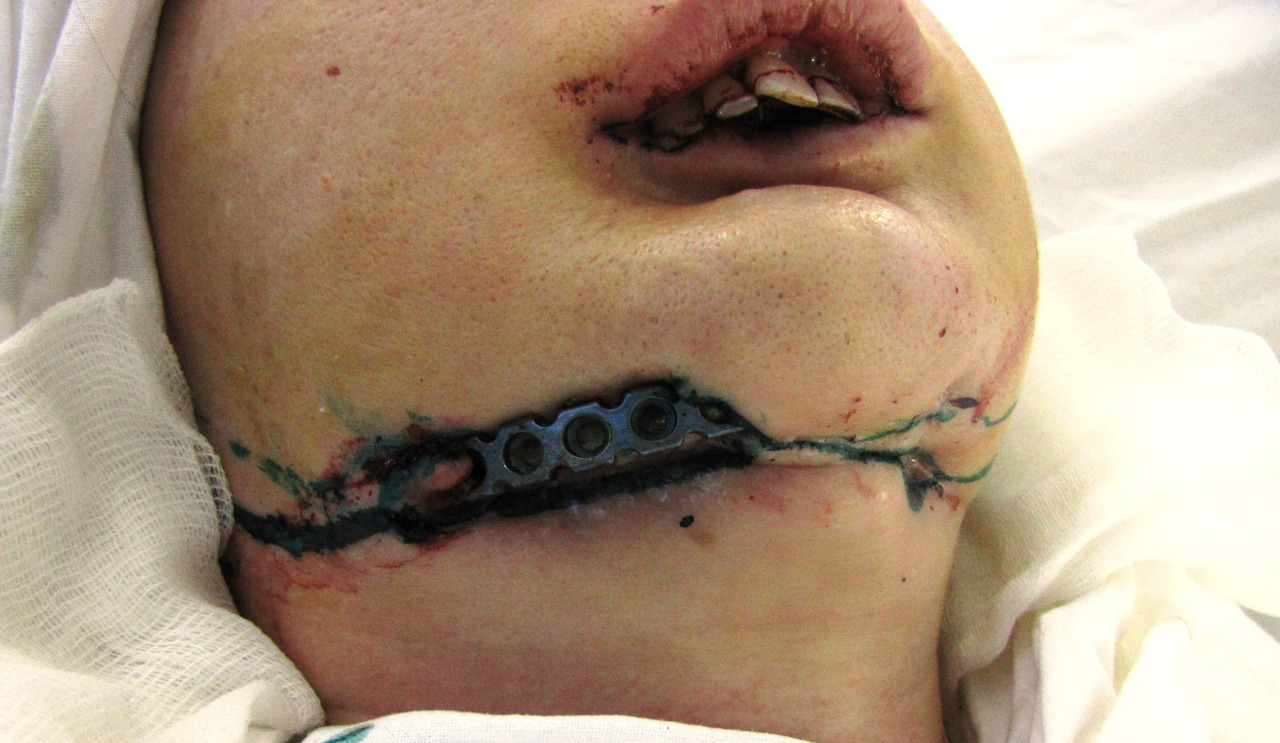
Лечение больных с «дезоморфиновыми» остеонекрозами следует начинать с консультации и лечения у нарколога. Минимальный срок начала оперативного лечения после прекращения приема наркотиков, согласно нашим данным, должен составлять не менее 6 месяцев. Госпитализация и лечение пациентов, продолжающих даже эпизодический прием наркотиков, лишены смыла в плане перспектив выздоровления и представляют риск для хирургов и отделения. Мы неоднократно сталкивались со случаями самовольного ухода больных из стационара сразу после установки подключичного катетера для проведения дезинтоксикационной терапии или после операции под наркозом. В ряде случаев имела место фальсификация результатов анализов перед операцией. Возможно распространение остеонекроза на близлежащие участки челюсти после удаления подвижных зубов или кюретажа лунки удаленного зуба, формирование свищей в верхнечелюстной синус и полость носа, развитие неврита ветвей тройничного нерва, расхождение швов, прорезание реконструктивных пластин через кожу и слизистую оболочку полости рта (рис. 1, 2).
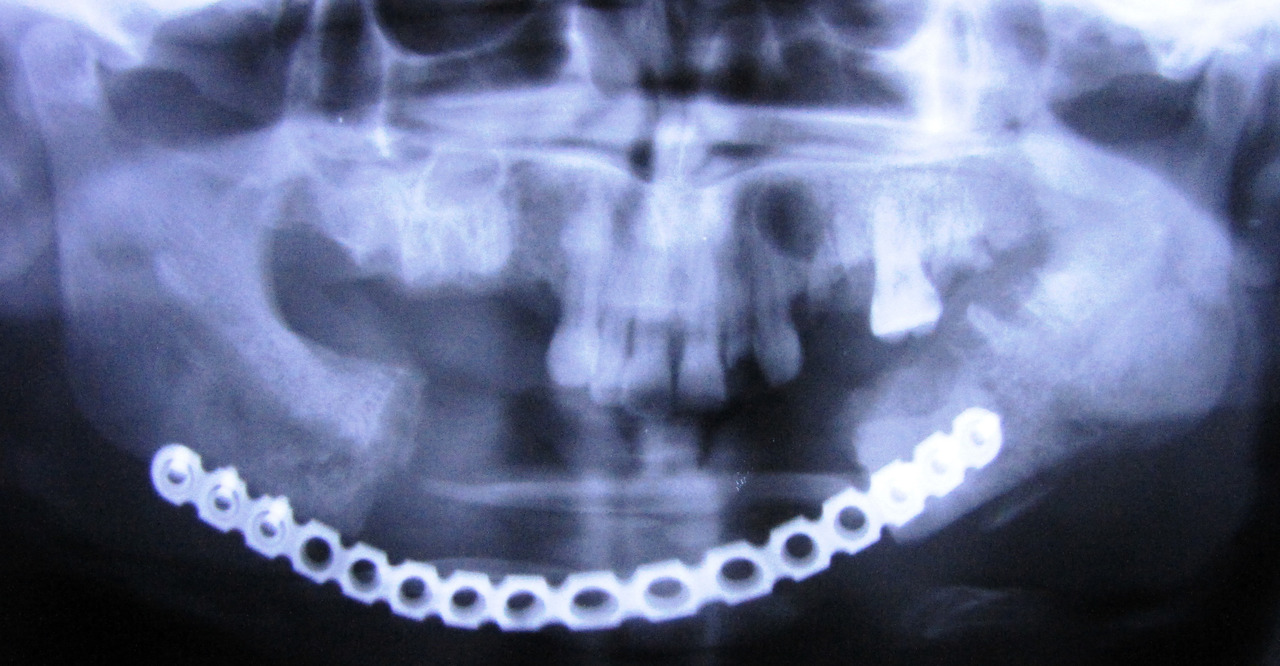
Рис. 1. Больная Ж., 30 лет. Распространение зоны остеонекроза после сегментарной резекции нижней челюсти и установки реконструктивной пластины.
В подобных случаях неудовлетворительный результат операции может рассматриваться пациентами как «врачебная ошибка».
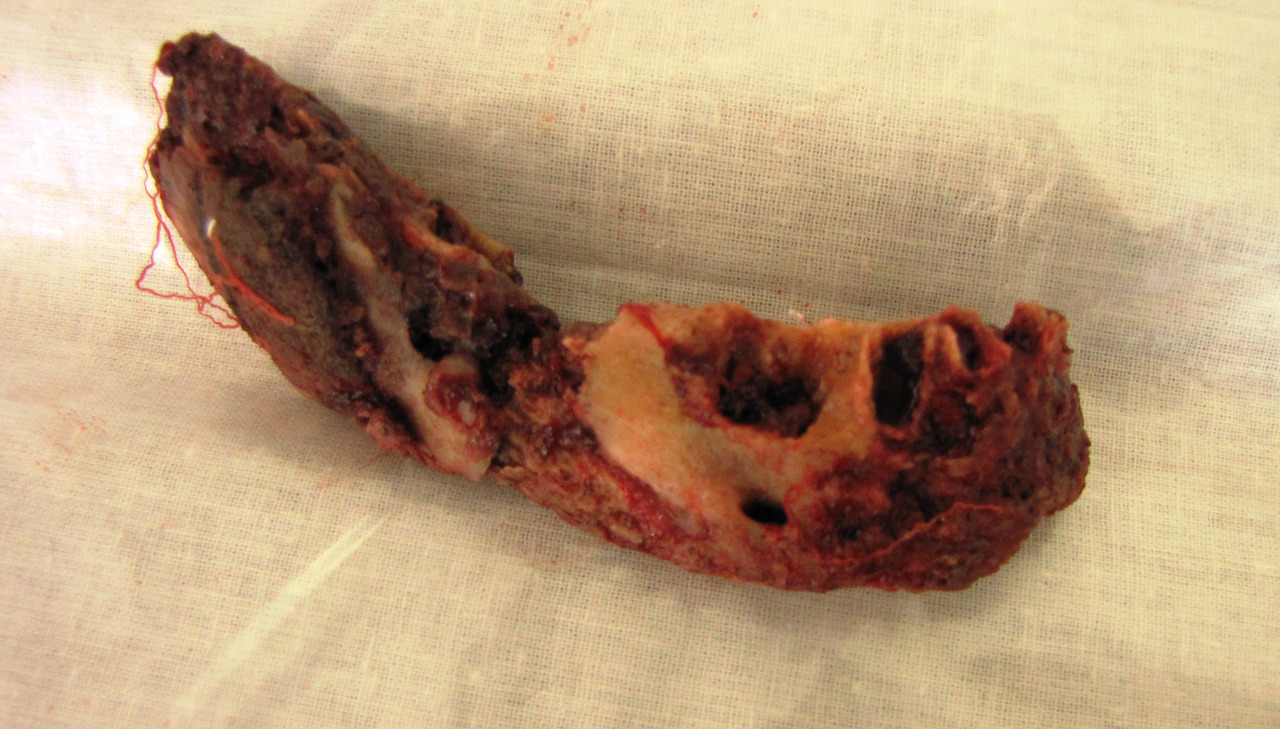
Лучшие результаты лечения мы наблюдали в случаях, когда пациенты обращались в клинику спустя 2—3 года после прекращения приема кустарного дезоморфина по причине заключения под стражу. У них имела место демаркация очага остеонекроза (рис. 3), сформированные секвестры (рис. 4), что требовало небольшого по объему, кратковременного оперативного лечения, иногда даже под местной анестезией. После удаления таких отграниченных секвестров воспалительно-некротический процесс на пораженной челюсти прекращается, но может продолжаться на другой (рис. 5).
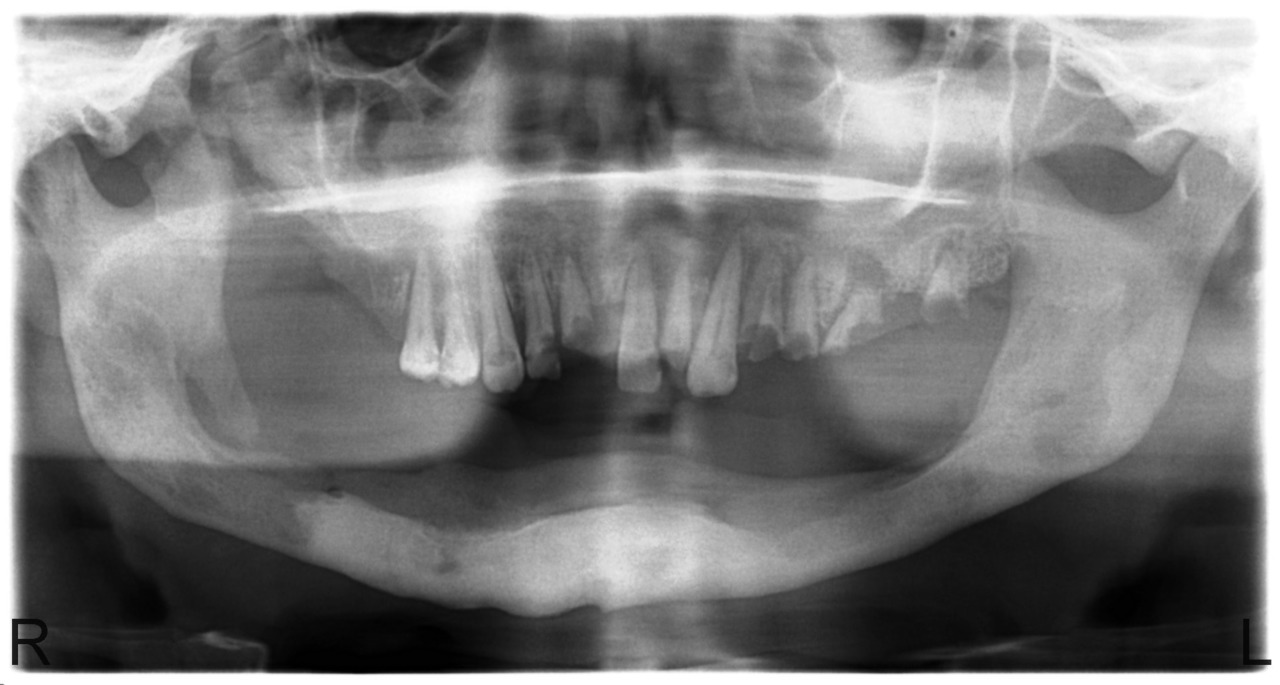
Рис. 5. Больной Ш., 31 года. Состояние спустя 8 месяцев после секвестрэктомии на нижней челюсти. Диффузный остеонекроз альвеолярного отростка верхней челюсти.
Основной вопрос, который стоит перед хирургом, сталкивающимся с проблемой выбора оперативной тактики, это определение жизнеспособности костной ткани и границы иссечения некротизированной кости. Если секвестры не сформированы, то по данным рентгенологических методов (включая компьютерную томографию) или даже визуально во время операции границы остеонекроза определить сложно (рис. 6).
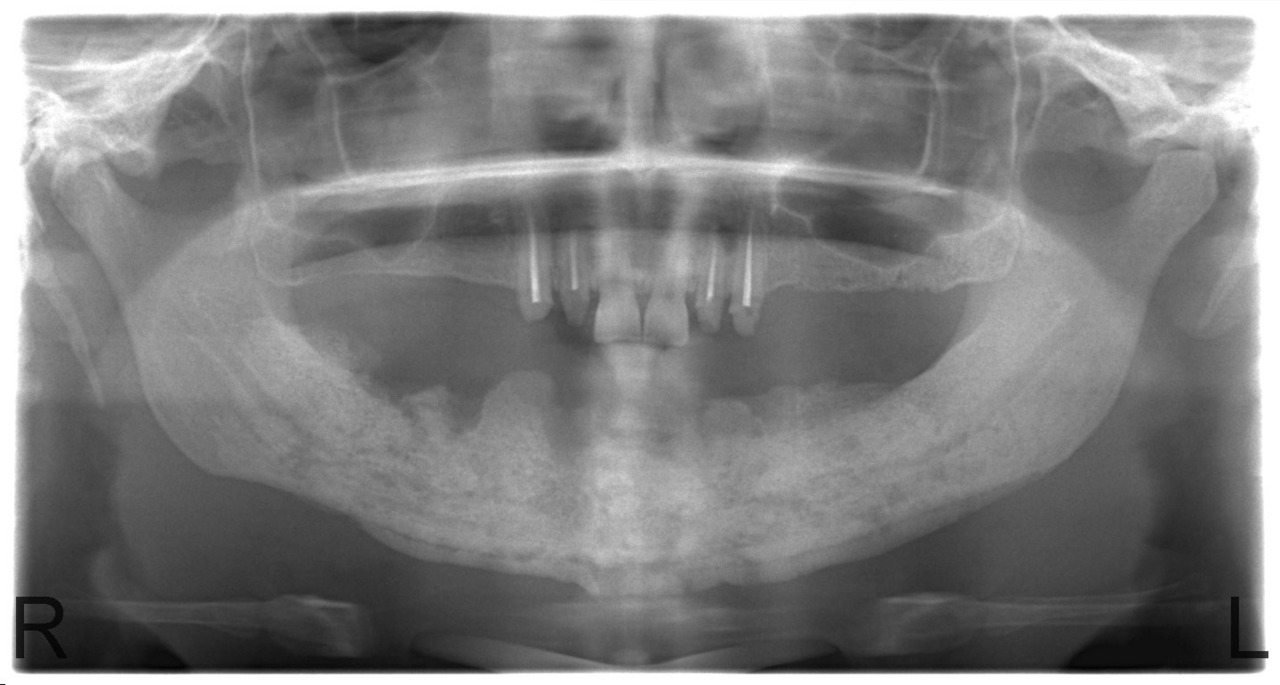
Рис. 6. Больная С., 28 лет. Диффузный остеонекроз тела и ветвей нижней челюсти с гипертрофией надкостницы без зоны демаркации.
Под видимо не измененной наружной кортикальной пластинкой часто мы выявляли некроз губчатого вещества кости. На ощупь некротизированная кость шершавая, с зеленоватым оттенком. После остеонекрэктомии края кости напоминают «мокрый сахар». Но это лишь субъективные критерии. В 90 % случаев после резекции кости в пределах видимо здоровых тканей мы сталкивались с рецидивом заболевания. Спустя 2—3 недели после операции на фоне длительной терапии остеотропными антибиотиками, иммуностимуляторами, проводимой физиотерапии формируются стойкие свищи на коже или в полости рта. При ревизии раны мы удаляли обильные вялые грануляции в мягких тканях и находили гнезда некроза вокруг фиксирующих реконструктивные пластины винтов. В одном случае после удаления 2/3 нижней челюсти мы столкнулись с крайне редко возникающим случаем резорбции мыщелкового отростка ветви нижней челюсти (рис. 7), планируется установка эндопротеза ВНЧС.
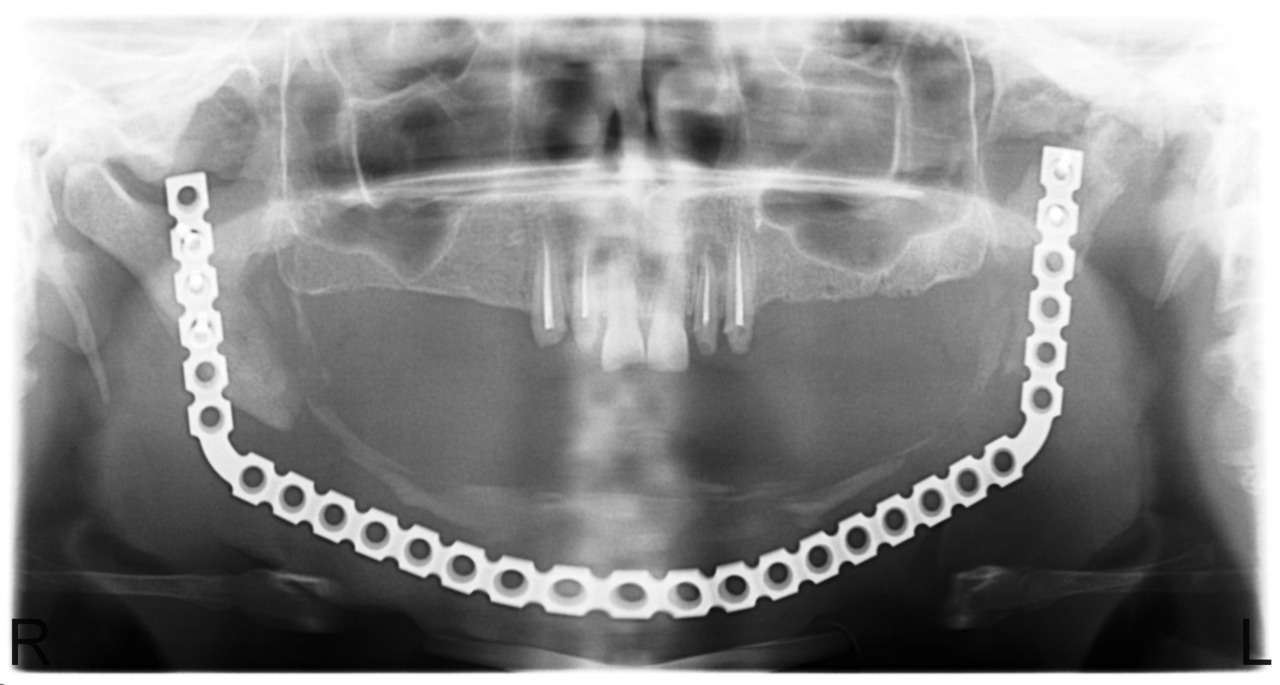
Рис. 7. Больная С., 28 лет. Состояние после субтотальной резекции тела и ветвей нижней челюсти. Остеонекроз мыщелкового отростка ветви нижней челюсти слева.
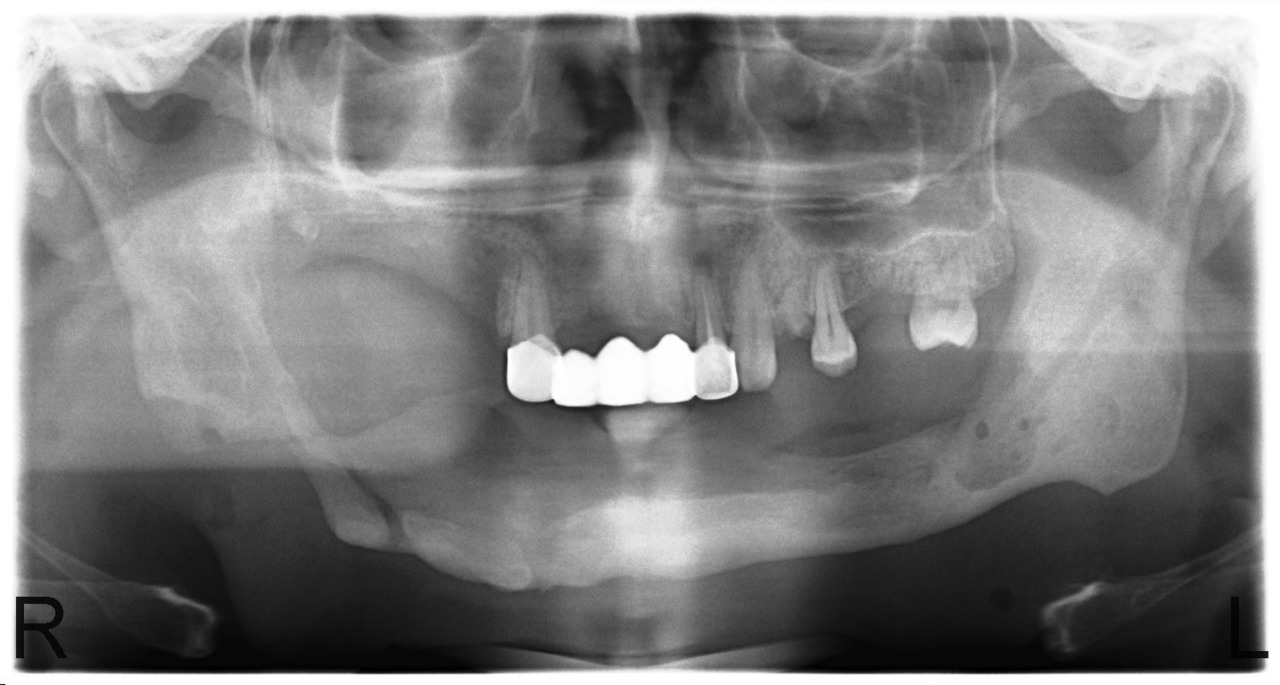
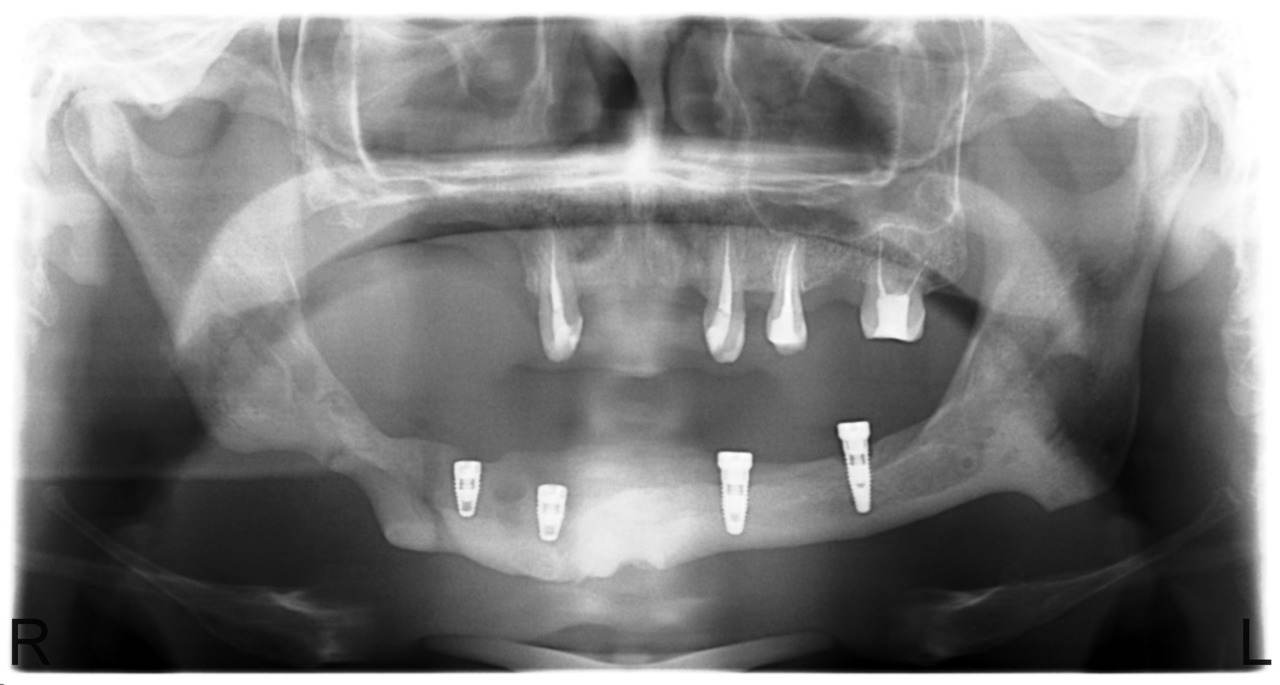
В случае сформированных секвестров этот вопрос не стоит, так как зона демаркации легко определяется визуально, а после секвестрэктомии мы пальпируем выстланную грануляциями костную полость с гладкими краями. Рецидив заболевания в этих случаях мы наблюдали у 12,5 % больных. Привожу в пример серию рентгенограмм пациента У., с диффузным остеомиелитом тела нижней челюсти и очаговым остеомиелитом верхней челюсти в области бугра и зубов 1.7, 1.6, 1.5 (рис. 8, 9, 10, 11).
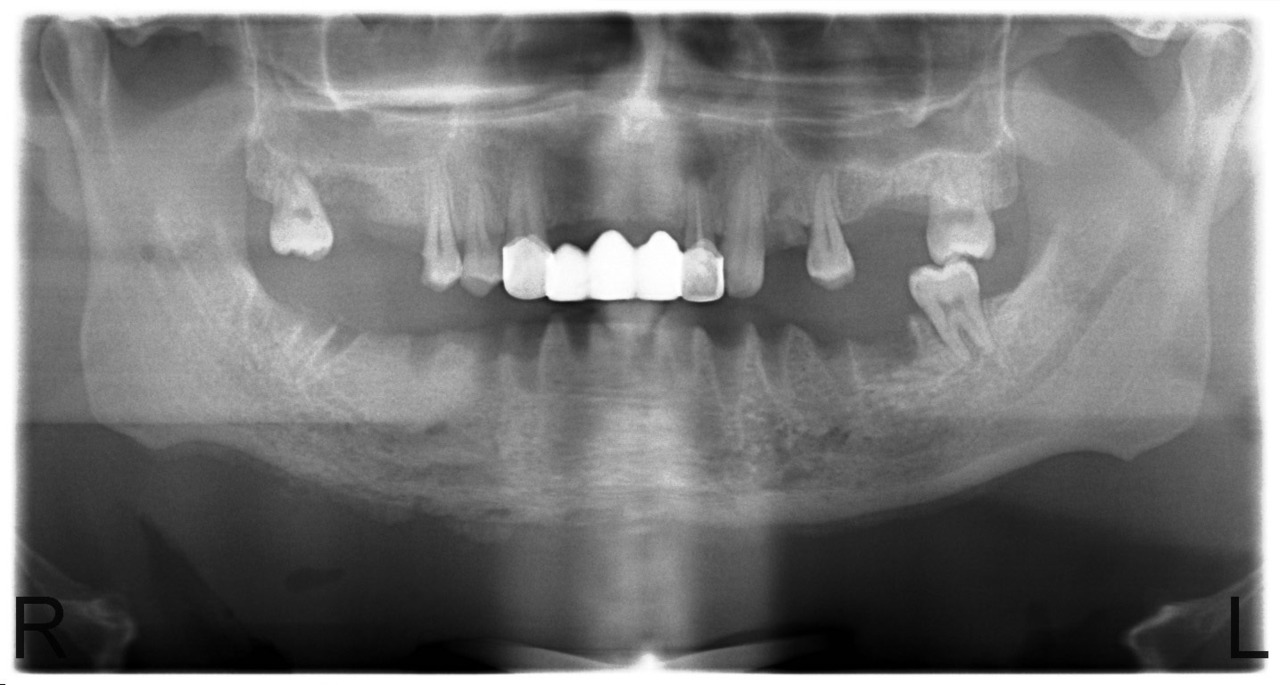
Рис. 8. Больной У., 28 лет. Диффузный остеонекроз тела нижней челюсти без зоны демаркации (апрель 2010).
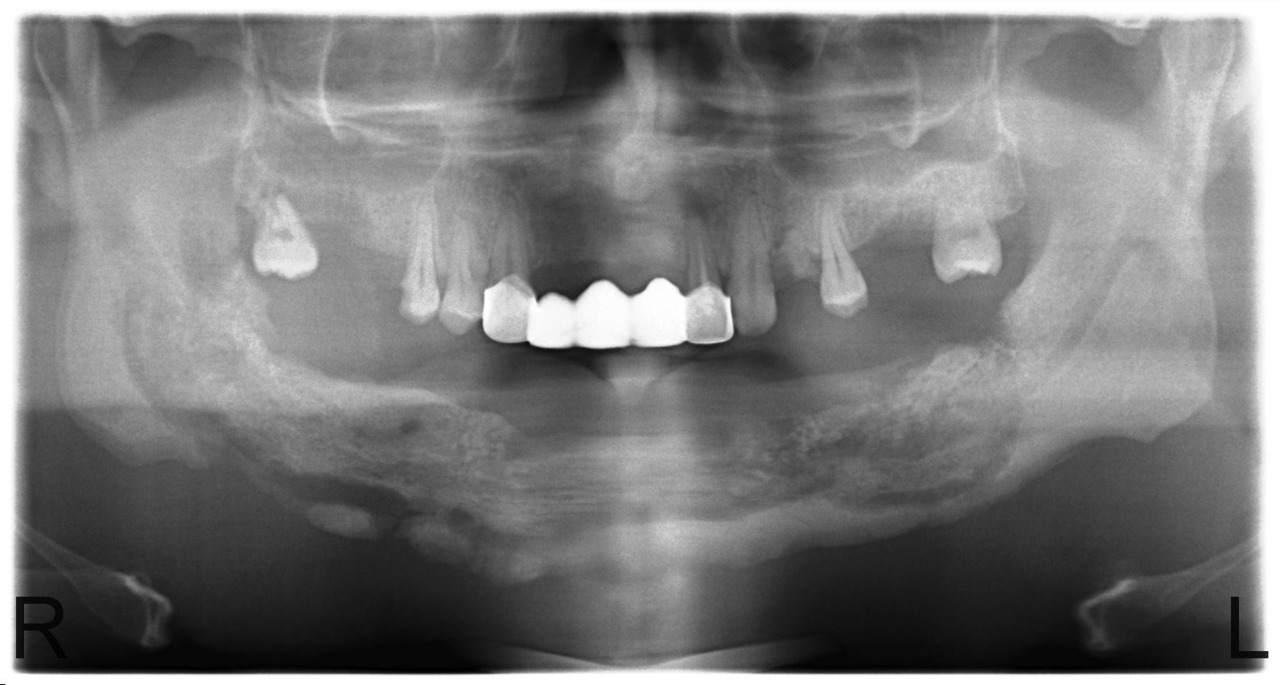
Рис. 9. Больной У. Секвестрация тела нижней челюсти с выраженной зоной демаркации и сформированным секвестром (июнь 2010).
Больному в течение 4 лет последовательно были выполнены 5 операций: остеонекрэктомия альвеолярной части, секвестрэктомия в области тела нижней челюсти с установкой реконструктивной пластины, удаление реконструктивной пластины и секвестрэктомия в области бугра верхней челюсти, установка дентальных имплантатов. После удаления значительного по объему секвестра тела нижней челюсти удалось сохранить часть внутренней кортикальной пластинки толщиной 1—2 мм, но непрерывную на всем протяжении. Спустя год мы наблюдали феномен новообразования кости на всем протяжении тела челюсти о объеме до 1 см по высоте и ширине, перфоративное отверстие в верхнечелюстной синус самостоятельно закрылось. Было решено отказаться от костной пластики из-за значительных рубцовых изменений тканей дна полости рта и высокого риска осложнений. Больной готовится к установке балочной конструкции с опорой на 4 имплантата.
Таким образом, основываясь на 5-летнем опыте лечения 72 больных с «дезоморфиновым» остеомиелитом челюстей, которым совокупно было выполнено 189 оперативных вмешательств, мы пришли к выводу о предпочтительности классической хирургической тактики: проведение оперативного лечения после появления зоны демаркации и формирование секвестров. Тотальные и субтотальные резекции челюстей являются калечащими операциями с высоким риском осложнений.