Роль современных методов разрушения биопленки в комплексе поддерживающей пародонтальной терапии
Р. Т. Буляков
д. м. н., доцент, заведующий кафедрой стоматологии общей практики ИПО БГМУ, главный внештатный стоматолог Министерства здравоохранения Республики Башкортостан, заслуженный врач Республики Башкортостан, главный врач АУЗ «Республиканская стоматологическая поликлиника» (Уфа)
О. А. Гуляева
к. м. н., ассистент кафедры стоматологии общей практики ИПО БГМУ, врач- пародонтолог АУЗ «РСП» (Уфа)
Д. Н. Тухватуллина
к. м. н., доцент кафедры стоматологии общей практики ИПО БГМУ, заместитель главврача по лечебной части АУЗ «РСП» (Уфа)
Г. А. Саляхова
к. м. н., доцент, завуч кафедры стоматологии общей практики ИПО БГМУ, заведующая лечебно-профилактическим отделением АУЗ «РСП» (Уфа)
Профилактика и лечение воспалительных заболеваний пародонта являются серьезной стоматологической, общемедицинской и социальной проблемой, решение которой остается основным направлением современной стоматологии ввиду того, что эти заболевания являются наиболее распространенными после кариеса в мире, отличаются рецидивирующим течением и сложно поддаются терапии, несмотря на совершенствование методов диагностики и внедрение новых технологий [10, 11, 13, 15]. Хронический генерализованный пародонтит резистентен уже на этапе проведения инициальной терапии.
Воспалительные заболевания пародонта не только являются основной из причин потери зубов, но и могут привести к осложнениям, связанным с угрозой жизни пациента. Хронический пародонтит является одним из факторов риска развития системного воспалительного ответа, провоцирующего поражение сосудов, возникновение или утяжеление атеросклероза, сахарного диабета, ишемической болезни сердца, он повышает опасность инсульта и инфаркта миокарда в три раза, а также риск осложнений во время беременности больше, чем алкоголь или курение [1, 2, 11, 15].
Основным причинным фактором возникновения воспалительных заболеваний пародонта можно назвать субгингивальную пародонтальную микрофлору. Уровень знаний об этиологии и патогенезе воспалительных заболеваний пародонта заставляет признать бактериальную модель возникновения и течения заболевания как одну из причин, которую необходимо рассматривать в комплексе с индивидуальной реакцией организма человека и воздействием внешних факторов.
Результаты эпидемиологических и клинико-лабораторных исследований подтверждают, что возникновение воспалительных заболеваний пародонта складывается из следующих факторов: бактерии, реакция макроорганизма, внешняя среда [10, 11, 13, 15].
Сложно недооценить роль поддесневой биопленки в возникновении и хроническом рецидивирующем течении воспалительных заболеваний пародонта — уровень научных знаний об этиопатогенезе пародонтита определяет пародонтальную микрофлору в составе биопленки в качестве доминирующего этиологического фактора. Биопленка — это организованные в микроколонии, взаимодействующие микроорганизмы, сгруппированные при помощи вырабатываемого ими защитного адгезивного липополисахаридного матрикса.
Сами бактерии составляют 5—35 % массы биопленки, остальная часть — межклеточный матрикс. Микроорганизмы в биопленке существуют и ведут себя не так, как бактерии в культуральной среде. К примеру, бактерия в биопленке может вырабатывать такие факторы вирулентности, которые она не продуцирует, будучи в культуральной среде, и иметь резистентность к препаратам губительным для нее в лабораторной культуре.
Матрица биопленки формирует экологическое убежище, эффективно защищающее бактериальные клетки как от действия лекарственных препаратов, так и от иммунных защитных факторов макроорганизма. Микроорганизмы в биопленке более устойчивы к антибиотикам, антимикробным средствам и другим активным агентам. Механизм увеличения устойчивости бактерий к антибиотикам в биопленках обусловлен как ограничением проникновения антибиотиков через биопленку, так и генной изменчивостью у персистирующих в биопленке бактерий.
Для достижения эффективности антибактериального или противомикробного препарата в биопленке (применяемого как местно, так и системно) может потребоваться значительное увеличение концентрации препарата. Например, время проникновения ципрофлоксацина внутрь биопленки Pseudomonas aerogenosa увеличивается в 30 раз по сравнению со временем, требуемым для проникновения препарата внутрь одиночной клетки, а устойчивость к антимикробным препаратам возрастает в 50—1000 раз по сравнению со свободными и «флоттирующими» микроорганизмами.
Говорить об успехе пародонтальной терапии, и рассчитывать на долговременность результатов лечения без физического разрушения биопленки не приходится.
Решающим для успешного пародонтального лечения являются постоянный контроль за реинфекцией в карманах и профилактические мероприятия. Только за счет точного мониторинга карманов и профессиональной гигиены в сочетании с удалением поддесневой бактериальной пленки можно избежать реинфекции или замедлить ее наступление [5, 7, 12, 13, 15].
Неотъемлемой частью всех схем лечения и профилактики воспалительных заболеваний пародонта на различных стадиях является рациональная индивидуальная гигиена полости рта.
Профессиональная же гигиена полости рта — не только составная часть лечебных мероприятий, но и краеугольный камень системы профилактики заболеваний пародонта [2—5, 7, 10, 11, 13, 15], базовая составляющая поддерживающей пародонтальной терапии (Supportive Periodontal Therapy — SPT).
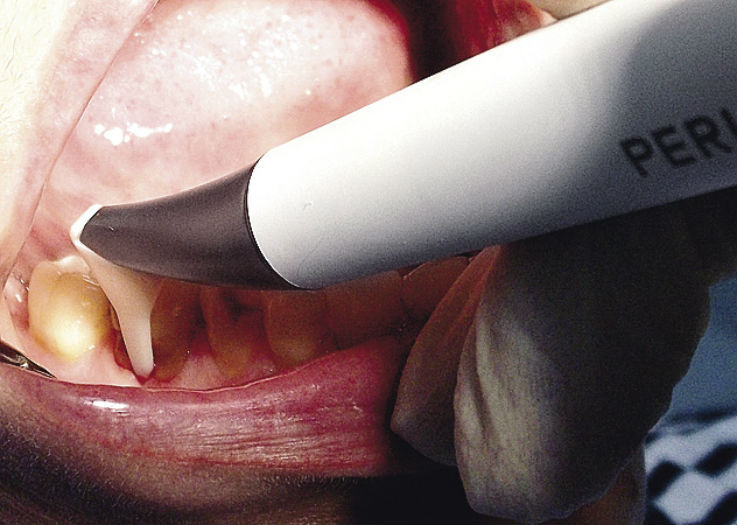
В литературе имеется множество подтверждений эффективности методов воздействия на поддесневую биопленку в комплексе первичного пародонтального лечения. По данным ряда авторов, эти методы, в частности, ультразвуковая терапия с суспензией гидроксиапатита кальция — Vector (Durr, Германия) — и воздушно-абразивная субгингивальная терапия взвесью глицина —
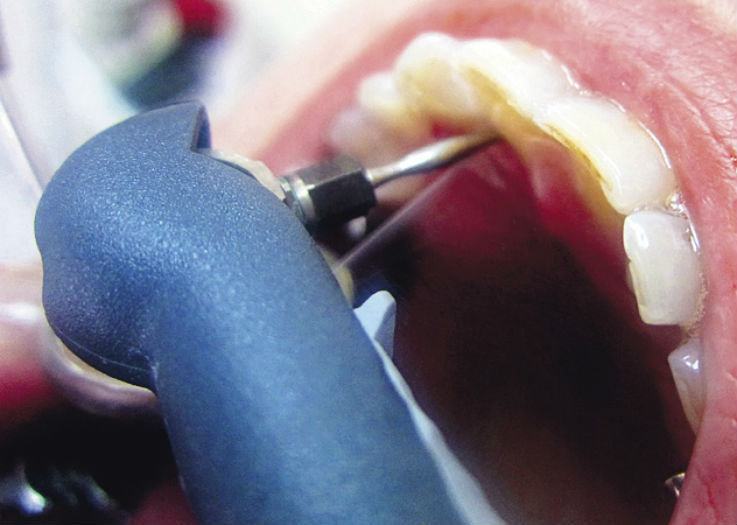
Perio-Flow (EMS, Швейцария), — являются целенаправленными щадящими способами минимально инвазивной терапии, позволяющей добиться разрушения биопленки [3—6, 8, 9, 14].
Пародонтальная терапия будет неэффективной без поддержки. Cанация пародонтальных карманов позволяет подавить поддесневую микрофлору, вызывающую пародонтит, но в течение дней или месяцев контаминация пародонтальными патогенами может достичь того же уровня, что и до лечения. Реинфекция к началу поддерживающей пародонтальной терапии часто является следствием недостаточного первичного лечения. Тщательная SPT — ключ к успеху пародонтологического лечения [7, 12, 13, 15].
Поддерживающая пародонтальная терапия — часть пародонтологической терапии, проводимая пародонтологом либо гигиенистом под наблюдением стоматолога и включающая в себя:
- обновление медицинского и стоматологического анамнеза;
- внутриротовое и внеротовое обследование мягких тканей, слизистой оболочки (онкологическая настороженность);
- пародонтологическое обследование;
- обследование зубов, имплантатов;
- оценку состояния окклюзии;
- оценку эффективности индивидуальной гигиены полости рта с повторным инструктажем по гигиене;
- рентгенологическое исследование, отслеживание динамики;
- удаление поддесневого и наддесневого камня и налета;
- устранение микрофлоры из зубодесневой борозды и пародонтальных карманов;
- селективное сглаживание поверхности корня (по показаниям);
- полирование зубов;
- фторирование зубов;
- антимикробное, хирургическое лечение по показаниям;
- консультирование со смежными специалистами при необходимости;
- информирование пациента о настоящем статусе и определение сроков следующего этапа SPT [15].
При визите к стоматологу для проведения SPT проводится оценка следующих параметров пародонтологического статуса (к п. 3 вышеперечисленного списка манипуляций в рамках поддерживающей пародонтальной терапии):
- глубина карманов при зондировании;
- кровоточивость при зондировании;
- общий уровень налета и камня;
- степень вовлечения бифуркации;
- наличие экссудации;
- состояние окклюзии и подвижности зубов;
- рецессия десны;
- состояние протеза или абатмента (при наличии имплантатов);
- состояние окклюзии.
SPT начинается после окончания активного пародонтологического лечения (Американская академия пародонтологии, 2000), продолжается пожизненно, регулярно с подбираемой индивидуально периодичностью с целью оказания помощи пациенту в поддержании здорового состояния структур полости рта. Профилактические мероприятия проводят в области всех зубов и имплантатов. В случае прогрессирования заболевания SPT может быть временно прервана и переведена в активную фазу.
Доказано, что вероятность потери зубов обратно пропорциональна количеству посещений пародонтолога (или сеансов SPT) [Американская академия пародонтологии, 2000]. Через 10 лет после окончания активного пародонтологического лечения у пациентов, которые периодически подвергались SPT, глубина карманов при зондировании была значительно меньше, а случаи потери зубов реже по сравнению с пациентами, которым SPT не проводили [12].
Многие исследования продемонстрировали эффективность SPT, показав, что у пациентов, которые регулярно подвергаются SPT, наблюдается меньшая потеря прикрепления и зубов, чем у тех, кому сеансы проводят SPT проводят менее регулярно или не проводят вообще, а также что прогрессирование гингивита в пародонтит можно предотвратить или замедлить с помощью оптимальной индивидуальной гигиены или периодического проведения SPT [7]. Поскольку пациенты редко могут обеспечить эффективное удаление налета, процедуры SPT позволяют снизить риск потери прикрепления.
В современной пародонтологии, как и в автосервисе, интервалы между «инспекционными осмотрами» и объем поддерживающей терапии планируются в соответствии с уровнем индивидуального риска [10]. Апробированы различные подходы к тому, чтобы реализовать эту идею на практике, однако стандартная программа до сих пор не сложилась.
При выборе частоты SPT и объема мероприятий все еще служит клинический опыт. Учитываются следующие факторы и параметры [10]:
- количество зубов;
- количество карманов с глубиной более 5 мм;
- процент карманов с положительным тестом на кровоточивость;
- деструкция кости в области боковых зубов (учитывая возрастной фактор);
- соматический и генетический фактор;
- количество сигарет, выкуриваемых в течение дня;
- уровень психосоциального стресса.
Для большинства пациентов, страдающих гингивитом, но без потери пародонтального прикрепления в анамнезе достаточно посещать стоматолога каждые шесть месяцев. Пациентам, имеющим в анамнезе пародонтит, показано посещение стоматолога каждые три месяца, поскольку именно при наличии таких интервалов снижается вероятность прогрессирования заболевания по сравнению с пациентами, подвергающимся SPT реже.
Интервалы в 3 месяца между сеансами SPT считаются достаточными для проведения эффективной терапии и стойкого подавления потенциально патогенных микроорганизмов, но они могут варьироваться в зависимости от клинической ситуации. При повторном возникновении заболеваний пародонта необходимо рассмотреть возможность проведения дополнительных диагностических и лечебных мероприятий.
Промежутки между курсами SPT можно изменять в зависимости от данных новых исследований и публикаций, а также мнения стоматолога.
Несоблюдение рекомендованных интервалов SPT может повлиять на результат терапии. К сожалению, многолетний опыт ряда авторов говорит о том, что большинство пациентов (55—84 %) не склонны соблюдать предложенный режим визитов к пародонтологу, 28 % пациентов в рамках программы поддерживающей терапии не являются уже на первое посещение к врачу [12].
Цель исследования — оценка влияния методов воздействия на субгингивальную биопленку в комплексе поддерживающей пародонтальной терапии.
Материалы и методы
Объект исследования — 123 пациента пародонтологического подразделения хирургического отделения АУЗ «Республиканская стоматологическая поликлиника» г. Уфы, проходивших SPT, из них 72 (57,7 %) — женщины, 51 (42,3 %) — мужчины. 50,4 % (62) пациентов наблюдались с диагнозом «хронический генерализованный пародонтит средней степени тяжести», 30,9 % (38) — с пародонтитом тяжелой степени, 18,7 % (23) — с пародонтитом легкой степени.
После проведения комплексной базовой терапии проводились сеансы поддерживающей пародонтальной терапии с индивидуально подобранными интервалами: через 3—7 недель — 1-е посещение, через 2—3 месяца — 2-е, через 6 месяцев — 3-е и еще через 6 месяцев — 4-е.
В комплексе SPT 1-й группы наблюдаемых (группа V — 48 человек) проводили процедуру Vector в рамках регулярной профессиональной гигиены (рис. 1), во 2-й группе (группа P — 31 человек) — процедуру Perio-Flow (рис. 2), в 3-й группе (группа VP — 21 человек) эти две процедуры чередовали, в контрольной группе (23 человека) проводилась стандартная профессиональная гигиена пъезоэлектрическим скейлером и воздушно-абразивная полировка. Соотношение пациентов с пародонтитом легкой, средней и тяжелой степени в каждой группе составило 1 : 2 : 1.
Для оценки состояния тканей пародонта и анализа результатов проводимой терапии заполнялась модифицированная нами пародонтограмма, где фиксировалась глубина пародонтального кармана (ПК) с определением следующих показателей:
- индекс гигиены полости рта Silness-Loe (S-L) (Silness, Loe, 1967),
- упрощенный индекс гигиены полости рта OHI-S (J. C. Green, J. K. Vermillion, 1963),
- оценка кровоточивости десен по индексу PBI (papilla bleeding index) (Мuhllemann-Sukser),
- пародонтологический индекс PMA (Schour, Massler) в модификации Parma для количественного определения степени выраженности воспаления.
Глубину ПК определяли с помощью стандартной методики, делая по 3 измерения с вестибулярной и небной поверхности 6 зубов у каждого из пациентов (1.6, 2.5, 2.6, 3.6, 3.1., 4.6) пародонтальным калибровочным зондом (D=0,5мм) со стандартным давлением 240 N/см, регистрируя глубину с точностью до 1 мм. Для оценки состояния костной ткани проводили цифровую ортопантомографию на аппарате TROPHYPAN eXpert DC. Статистический анализ данных осуществляли с использованием стандартных пакетов программ прикладной статистики.
При описании количественных признаков использовали среднюю арифметическую (М), стандартную ошибку средней (m), при описании качественных признаков вычислялись относительные доли и стандартная ошибка доли. Проверка статистических гипотез заключалась в сравнивании полученного уровня значимости (р) с пороговым уровнем 0,05. При р<0,05 нулевая гипотеза об отсутствии различий между показателями отвергалась и принималась альтернативная гипотеза.
Результаты исследования
Изучение пародонтологического статуса пациентов в 1-е посещение достоверной статистически значимой разницы не выявило, гигиена полости рта и индексы воспаления десны остались на уровне (с незначительным сдвигом), зафиксированном после фазы активного лечения. Пациентам были проведены необходимые процедуры и повторный инструктаж по индивидуальной гигиене.
Через 3 месяца разница в степени выраженности воспаления в тканях пародонта (согласно индексу PMA) и кровоточивости десны между контрольной и основными группами увеличилась — значения индекса кровоточивости составили в группе V 1,21 ±0,06, в группе P 1,19 ±0,08, в группе VP 1,18 ±0,08, в контрольной 1,8 ±0,04.
Уровень индексов гигиены полости рта через 3 месяца увеличился во всех группах, но в контрольной более значимо, особенно индекс придесневого налета S-L: в основной группе он увеличился на 26,5 ± 2,9 % (в 3 основных в среднем на 9,8 ± 1,1 %) (p < 0,05), что, по нашему мнению, свидетельствует о решающей роли разрушения биопленки в комплексе SPT для снижения ретенции микробного налета, образования зубных отложений, а соответственно, и генерации воспалительного процесса и деструкции пародонтальных тканей.
Следует отметить, что в динамике уровень индексов PMA и PBI на всех этапах SPT в исследовательских группах был значительно ниже, чем в контрольной.
Изменение глубины ПК через 3 месяца после проведенной терапии в группах P и V с незначительной статистически незначимой разницей составило в среднем 1,19 ± 0,08 мм. Уровень редукции глубины ПК в группах пациентов с проведенной Vector- и Perio-терапией значительно отличался от показателей группы со стандартным схемой: в контрольной группе ее значение составило всего 0,32 ±0,05 мм (p<0,01).
Через 6 месяцев (3-е посещение) у 2 пациентов из контрольной группы (8,69 ± 0,9 %) произошло обострение пародонтита (тяжелой степени), среди трех основных групп — у одного из пациентов (1,0 ± 0,9 %) — легкой степени после респираторного вирусного заболевания (группа V). К 4-му посещению (еще через 6 месяцев) обострение произошло у 4 пациентов контрольной группы (из них у одного во второй раз), среди пациентов основных групп обострение воспалительного процесса диагностировано у 2 пациентов с тяжелой степенью пародонтита, оставшимся 97 (из 100) пациентам был подтвержден клинический статус: ремиссия.
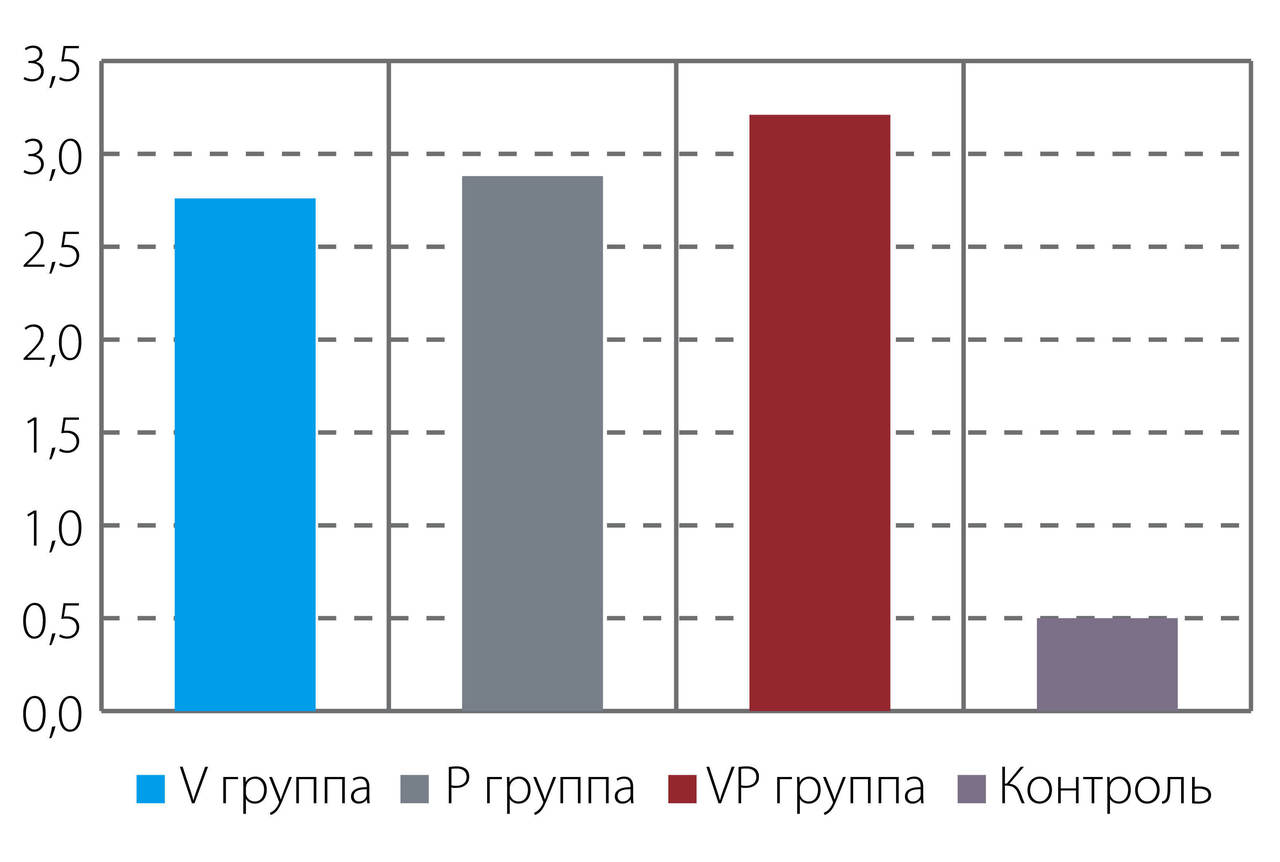
За весь период наблюдения максимальный уровень редукции глубины пародонтального кармана наблюдался в группе с комбинацией применения двух методов (и Vector, и Perio) -3,21 ± 0,14 мм, чуть меньший и примерно на одинаковом уровне 2,82 ± 0,14 мм в группах V и P и довольно низкий в контрольной группе — 0,5± 0,08 (p<0,01). Уменьшение глубины пародонтальных карманов (без применения хирургических методов) в исследовательских группах объясняется тем, что удаление биопленки и патологической грануляционной ткани во время процедур ведет к восстановлению биосовместимости тканей пародонта и заживлению пародонтального кармана.
Лучшие показатели лечения комбинированным способом, на наш взгляд, обусловлены особенностями клинического применения аппаратов — оба метода имеют свои технические нюансы и взаимодополняют друг друга, минимализируя погрешности в результатах. Эти методы, несмотря на одинаковые показания к применению и ожидаемые результаты, имеют в своей основе абсолютные разные механизмы работы, поэтому у каждого из них свои преимущества и недостатки и совместное их применение позволяет получить повышение эффективности SPT.
Пациентов с наличием узких глубоких пародонтальных карманов целесообразнее вести Vector-методом; если имеются обширные глубокие карманы, эффективнее будет Perio-метод. Пациентам с легкой степенью пародонтита (либо со средней в длительной ремиссии) достаточно Perio-профилактики обычным наконечником AIR-Flow.
Заключение
Успешная пародонтальная терапия и регулярное проведение курсов SPT могут улучшить состояние пародонта и снизить вероятность потери зубов. Длительность ремиссии заболеваний пародонта также зависит от активного ухода во время проведения SPT.
Результат поддерживающей пародонтальной терапии — минимизация прогрессирования заболеваний пародонта у пациентов, подвергшихся лечению, увеличение вероятности своевременного выявления и лечения других заболеваний или состояний в полости рта. Несомненно, SPT является нужной и эффективной для пациентов с воспалительными заболеваниями пародонта и должна иметь приоритет в ежедневной стоматологической практике.
Поддерживающая пародонтальная терапия с постоянным контролем мотивации индивидуальной гигиены и применением методов разрушения биопленки этиопатогенетически обоснована и является залогом успешных результатов лечения и профилактики в клинике пародонтологии.
Список литературы находится в редакции