Опыт клинического применения резцовой проводниковой анестезии при лечении резцов верхней челюсти
А. В. Кузин
к. м. н., Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии
В. В. Воронкова
к. м. н., Клинико-диагностический центр Первого Московского государственного медицинского университета им И. М. Сеченова
М. В. Стафеева
врач-стоматолог (Москва)
Нередко в клинической практике врач-стоматолог сталкивается с трудностями обезболивания зубов и мягких тканей в условиях воспаления. Для реализации фармакологического действия анестетика необходим его гидролиз в тканевой жидкости, pH которой в норме составляет 7,3—7,4. При одонтогенных воспалительных процессах рН тканевой жидкости снижается до 6—6,5. В таких условиях при этом значительная часть молекул анестетика не гидролизуется.
Можно выделить несколько основных принципов обезболивания при воспалительных периапикальных процессах. Депо анестетика создают в стороне от очага воспаления. В этом свете предпочтительнее проводниковые способы обезболивания, которые позволяют «обойти» воспалительный инфильтрат. Используют комбинацию нескольких методов инъекционного обезболивания для достижения полноценной анестезии.
В классических изданиях, посвященных вопросам обезболивания зубов, доказано, что после проведения резцовой проводниковой анестезии наступает анестезия не только мягких тканей передней 1/3 неба, но и пульпы резцов [2, 4, 5, 10]. В зарубежной литературе имеются данные об анестезии пульпы центральных резцов в 55—58 % и латеральных резцов в 48—58 % после проведения резцовой проводниковой анестезии [8]. Некоторые авторы предлагают использовать резцовую проводниковую анестезию как самостоятельный метод обезболивания резцов с применением автоматизированного шприца [10], однако данная методика неэффективна и не находит широкого применения. Другими авторами доказана эффективность резцовой проводниковой анестезии, проводимой дополнительно при недостаточности инфильтрационной анестезии при лечении резцов [13].
В настоящей статье мы приводим опыт применения комбинации инфильтрационной анестезии и резцовой проводниковой анестезии при обезболивании резцов верхней челюсти в условиях воспаления.
Особенности иннервации резцов верхней челюсти. Резцы верхней челюсти иннервируются передними верхними альвеолярными нервами (ПВАН) N.n alveolaris superiors anteriores (система тройничного нерва, верхнечелюстной нерв). ПВАН являются частью верхнего зубного сплетения, образованного передними, средними и задними альвеолярными нервами. ПВАН проходят через подглазничный канал, на середине длины которого они смещаются медиально в сторону дна носовой полости и перемещаются к верхушкам корней клыков и резцов. Альвеолярные каналы, содержащие в себе ПВАН, хорошо прослеживаются на конусно-лучевой томографии [7, 9, 14], их диаметр составляет 1,25—2,5 мм. В зарубежной литературе данные каналы называют извитыми (canalis sinuosis) [14, 15, 18]. Согласно международной анатомической терминологии, такого термина, как «извитой канал», нет: все микроканалы верхней челюсти, подходящие к корням зубов, именуются альвеолярными (Canalis alveolaris) [3].
В переднем отделе верхней челюсти наблюдается перекрестная иннервация резцов. ПВАН правой и левой стороны формируют густую сеть анастомозов, идущих к резцам и клыкам [4, 5, 16, 11]. В области центральных резцов ПВАН анастомозируют с носонебным нервом [7]. В литературе встречаются анатомические подтверждения иннервации резцов верхней челюсти резцовым нервом [17].
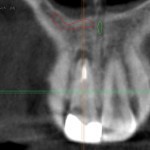
Изучение топографии резцового канала. С целью изучения внутрикостной анатомии резцового канала и передних верхних альвеолярных каналов нами проведено изучение архивных данных конусно-лучевой томографии 60 пациентов (томограф PaX-i3D Vatech). В прилагаемом программном обеспечении проводили серии срезов в области резцового канала и альвеолярных каналах передних верхних альвеолярных нервов.
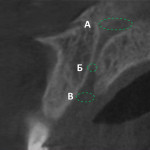
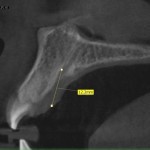
По результатам исследования были выявлены следующие особенности анатомии и топографии резцового канала. Резцовый канал начинается двумя раздельными носонебными отверстиями, которые открываются в передней части дна носовой полости с двух сторон от перегородки носа (рис. 1). Далее два канала объединяются в один резцовый канал, что придает ему Y-образную форму. Резцовое отверстие располагается кзади от центральных резцов верхней челюсти на 8—10 мм, сразу под резцовым сосочком. Длина резцового канала в среднем составляет 8—9,5 мм, по нашим данным, что сопоставимо с данными других авторов [13].
Нами выявлено несколько форм резцового канала (рис. 2). В большинстве случаев канал имеет форму песочных часов, реже встречается форма в виде воронки и цилиндра. В одном случае выявлено два параллельно расположенных в сагиттальной плоскости резцовых канала. Стоит отметить, что в литературе имеется описание от 4 до 6 форм резцового канала, представляющих крайние формы анатомии [7, 9].
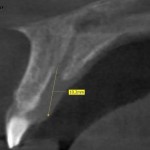
По нашему мнению, глубина продвижения иглы в резцовый канал напрямую влияет на наступление анестезии пульпы резцов. Мы провели измерения возможной глубины продвижения иглы в резцовый канал (рис. 2). Длина от вершины резцового сосочка до места сужения резцового канала составляет 9—12,5 мм (в среднем 10,6 мм). Таким образом, при проведении резцовой проводниковой анестезии мы рекомендуем продвигать иглу в резцовый канал на 8—10 мм или до контакта с костной тканью.
- рис. 1
- рис. 2а
- рис. 2б
- рис. 2в
- рис. 2г
В половине случаев (56 %) на КЛКТ нами выявлена взаимосвязь альвеолярных каналов и резцового канала. На уровне дна носа микроканалы ПВАН соединялись с резцовым каналом. В некоторых случаях микроканалы не соединялись с резцовым каналом, имели самостоятельный ход в толще альвеолярного отростка, открываясь на область передней 1/3 неба самостоятельными отверстиями. Зарубежными авторами эти «добавочные» отверстия именуются «foramina Scarpa» [18]. Эти отверстия выявлены нами в 26 % случаев.
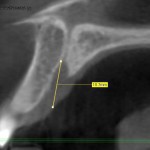
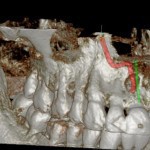
Указанные особенности резцового канала объясняют путь диффузии анестетика от резцового канала до верхушек корней резцов. При проведении резцовой проводниковой анестезии анестетик распределяется вглубь резцового канала до дна носовой полости, а по анастомозам к переднему зубному сплетению к верхушкам корней резцов (рис. 3).
Изучение клинической эффективности резцовой проводниковой анестезии. Нами изучена эффективность обезболивания резцов верхней челюсти в условиях воспаления. Проведено амбулаторное лечение 120 пациентов с диагнозом «периапикальный абсцесс без свища; нагноение радикулярной кисты».
Для обезболивания центрального или латерального резца со стороны причинного зуба проводили инфильтрационную анестезию в области клыка верхней челюсти, где создавали депо анестетика 0,8—1,2 мл («Убистезин форте»). Таким методом мы создавали депо анестетика в стороне от очага воспаления и блокировали передние верхние альвеолярные нервы.
После инфильтрационной анестезии дополнительно проводили резцовую проводниковую анестезию 0,6 мл («Убистезин форте»). За счет распределения анестетика вверх по резцовому каналу блокируются резцовый нерв и анастомозы передних верхних альвеолярных нервов с противоположной стороны.
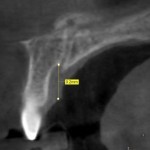
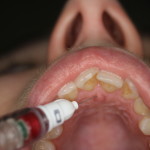
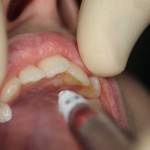
Резцовую проводниковую анестезию мы проводили в 3 этапа (рис. 4). Предварительно проводили аппликационную анестезию резцового сосочка с использованием ватной палочки, пропитанной аппликационным анестетиком. Через 5 минут проводили инфильтрационную анестезию резцового сосочка. Для снижения степени болезненности инъекции вкол иглы проводили сбоку от резцового сосочка, медленно вводили анестетик до появления признаков ишемии (примерно 0.1 мл). Третьим этапом проводили резцовую проводниковую анестезию по общепринятой методике: вкол иглы в резцовый сосочек, иглу продвигали вверх и кзади параллельно оси центрального резца. Продвижение иглы (30G (0,3мм), 27G (0,4 мм) Х 16 мм) осуществляли на глубину 8—10 мм или до соприкосновения острия иглы с костной тканью. Медленно создавали депо анестетика 0,5 мл.
- рис. 3а
- рис. 3б
- рис. 4а
- рис. 4б
- рис. 4в
Проведение резцовой проводниковой анестезии в три этапа позволяет снизить болезненность инъекции. Немаловажную роль в снижении боли играет скорость введения анестетика. Согласно международным стандартам EFAD и IFDAS, скорость введения раствора анестетика в ткани должна составлять 1 мл/мин. Исходя из этих данных введение 0,6 мл раствора в резцовый канал мы проводили за 30—40 секунд.
Для обезболивания мы использовали стандартный карпульный шприц и автоматизированный инъектор (TSD SleeperOne), который существенно облегчает контроль за скоростью введения раствора анестетика [5, 6]. Встроенная в аппарат программа регулирует подачу анестетика: на начальном этапе анестетик подается капельно, со скоростью 1 капля/сек., затем анестетик подается со скоростью 1 мл/мин.
Для оценки эффективности проведенного обезболивания мы использовали шкалу С. Т. Сохова (1982) [1]. Всем пациентам проводили терапевтическое лечение зубов, по показаниям проводили послабляющий разрез, вскрытие периапикального очага, его дренирование. Согласно полученным нами данным, применяемая комбинация обезболивания позволила провести вмешательства полностью безболезненно в 85 % случаев. В 9 % случаев пациенты испытывали слабую боль, потребности в дополнительном обезболивании не было. В 6 % случаев проведение эндодонтического лечения было безболезненно, но при этом при проведении разреза пациент ощущал сильную боль, что потребовало проведения повторной анестезии. Для достижения полноценной анестезии проводили инфильтрационную анестезию (0,6 мл) в месте наибольшей болезненности.
На этапе динамического наблюдения за пациентами мы оценивали возможные постинъекционные осложнения от проведения резцовой проводниковой анестезии. Большинство пациентов сразу после проведения резцовой проводниковой анестезии испытывали чувство онемения носа (его внутренней части). В последующем перед проведением обезболивания мы всегда предупреждали больных о возможном появлении онемения носа после анестезии. При повторном осмотре на третьи сутки половина больных отмечает дискомфорт в области резцового сосочка: «чувство бугорка», «припухлость неба» (при внешнем осмотре признаков отечности, воспаления выявлено не было). На седьмые сутки при расспросе пациентов и осмотре каких-либо жалоб и осложнений выявлено не было. По нашим наблюдениям мы не выявляли случаев нарушения чувствительности в области передней 1/3 неба у пациентов. Нами также не выявлено признаков неврита: больные не отмечали боли в области дна носа, переднего отдела твердого неба, иррадиации болей. Мы считаем, что травмирование резцового нерва, безусловно, возникает при проведении резцовой проводниковой анестезии, однако оно минимально в связи с тем, что резцовый канал содержит в себе, помимо нервных структур, сосуды, жировую ткань, соединительную ткань, малые слюнные железы [12]. При медленном введении анестетика (1 мл/мин.) его распределение происходит постепенно без выраженной компрессии нервных структур, что подтверждается отсутствием постинъекционных неврологических осложнений у наших пациентов. Также современные карпульные иглы имеют малый диаметр и атравматичный скос, что тоже снижает степень травмирования тканей.
Заключение. В настоящее время при обезболивании зубов верхней челюсти в большинстве случаев показано проведение инфильтрационной анестезии. Анестезию со стороны неба проводят при хирургических вмешательствах (операции удаления зуба). Мы считаем, что проведение резцовой проводниковой анестезии (0,6 мл 4%-ного артикаина с эпинефрином «Убистезин форте») показано при терапевтическом и хирургическом лечении резцов верхней челюсти в условиях воспаления периапикальных тканей. Использование комбинации инфильтрационной анестезии с наружной стороны и резцовой проводниковой анестезии позволяет добиться полноценного обезболивания периапикальных тканей.
Список сокращений
ПВАН — передние верхние альвеолярные нервы
КЛКТ — конусно-лучевая компьютерная томография