Тактика лечения пациентов с дефицитом костной ткани альвеолярных отростков
Бывают клинические ситуации, когда практикующему специалисту трудно выбрать наиболее оптимальный вид оперативного вмешательства, костнопластический материал и способ имплантации. В настоящее время известно много методов устранения дефицита костной ткани перед проведением последующей дентальной имплантации, но сравнительного анализа этих методов нет.
Для оптимизации работы необходимо изучить различные методы диагностики, стандартизировать схему обследования пациентов с дефицитом костной ткани перед проведением реконструктивных операций. Это позволит выбрать наиболее оптимальный хирургический метод, определить количество биоматериала и решить вопрос об этапности планируемых манипуляций.
Материалы и методы исследования
Настоящее исследование основано на результатах костнопластических операций, проведенных в целях подготовки к последующей дентальной имплантации, в период 2007—2011 гг. у 356 больных с деформацией и атрофией костной ткани альвеолярных отростков челюстей. Пациенты были в возрасте от 25 до 60 лет. Из них женщины — 215 чел., мужчины — 141 чел. Пациенты с дефицитом костной ткани на верхней челюсти — 203 чел., на нижней челюсти — 153 чел. При подготовке к операции имплантации у всех пациентов имелись показания к костнореконструктивным операциям в целях восстановления объема и формы альвеолярных отростков челюстей.
Нами было выделено несколько методик костновосстановительных операций, выполняемых при наличии дефицита костной ткани альвеолярного отростка для подготовки к дентальной имплантации.
В качестве трансплантатов использовались ксеногенные материалы OsteoBiol: «Apatos», «Gen-Оs», «mp3», «Sp-Block», пластина «Cortical Lamina», а также их сочетания. Кроме того, в комбинации биоматериалов применяли опилки аутокости. Для закрытия биоматериала и лучшей его адаптации к кости применялась мембрана «Evolution».
Полученные результаты и обсуждение
Поднадкостничная трансплантация биоматериала проведена у 67 больных.
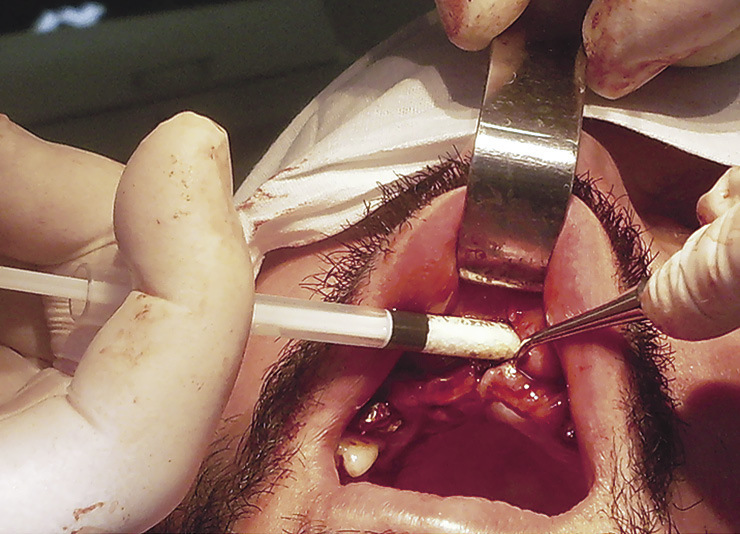
Показаниями для операции были недостаточные высота и ширина альвеолярного отростка и снижение окклюзионной высоты. Вмешательство проводилось в два этапа. В ходе первого через вертикальный разрез по альвеолярной дуге формировали тоннель и вводили ксеногенные материалы OsteoBiol: «Apatos», «Gen-Os», «mp3», «Sp-Block», а также их сочетания (рис. 1).
Предпочтение отдавали «mp3» (простота и контроль введения материала) и «Sp-Block» (обеспечение жесткого профиля создаваемого объема костного материала). В ходе второго этапа, спустя 6 месяцев, в альвеолярном отростке формировали ложа, устанавливали имплантаты, которые затем ушивали наглухо узловыми швами. Через 14 дней размещали капу, приспосабливали старый протез. Спустя 4—5 мес. вскрывали имплантаты и проводили протезирование. Остеокондуктивные материалы как клинически, так и рентгенологически к этому времени не реструктурировались в зрелую кость; остеоиндуктивные представляли плотную минерализованную кость. В 97 % случаев операции были успешны.
Трансплантация по типу накладки с подготовкой кости проведена у 42 человек.
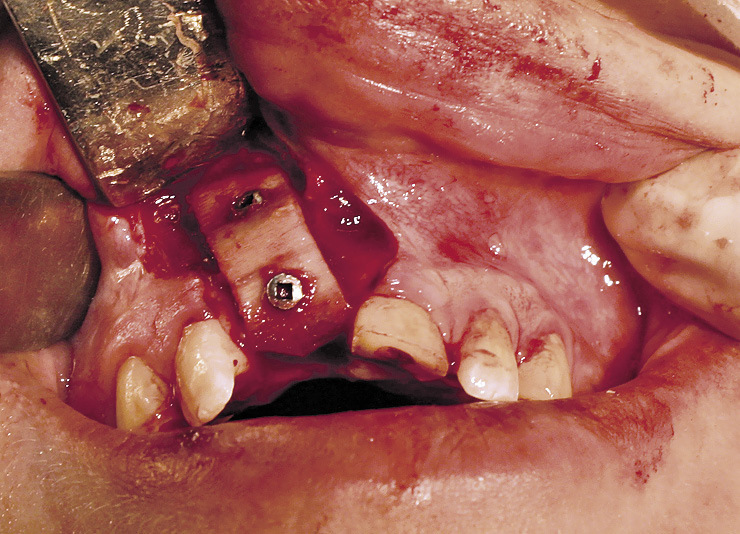
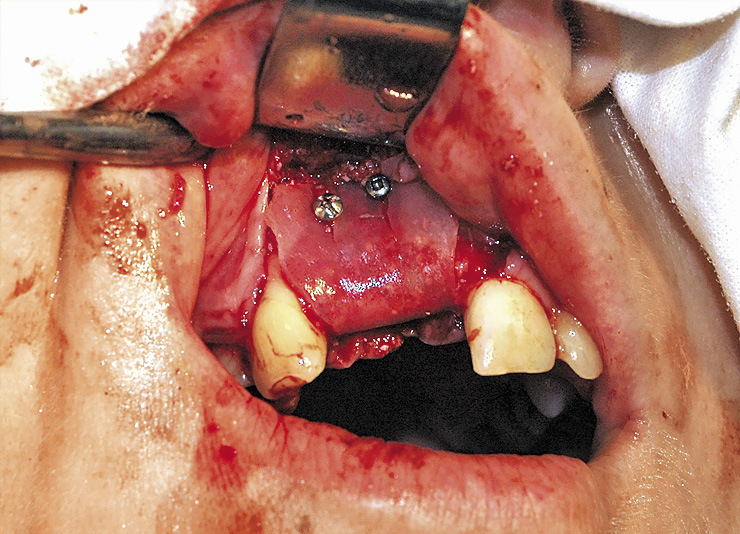
Показаниями для операции были недостаточная ширина и атрофия передней поверхности альвеолярного отростка, что создавало невозможность установки имплантата в правильное положение в соответствии с окклюзией. После традиционного трапециевидного разреза, обращенного в небную сторону, откидывания слизисто-надкостничного лоскута и скелетирования кости выполнили перфорацию кортикальной пластины по передней поверхности и на подготовленное костное ложе поместили биоматериал. Его фиксировали костными винтами и закрыли мембраной «Evolution». Для данного типа операций предпочтение отдавали костному блоку «Sp-Block», который обеспечивал создание жесткого профиля создаваемого объема костного материала, и пластине «Cortical Lamina», которая хорошо восстанавливает объем утраченной костной ткани с вестибулярной стороны альвеолярного отростка (рис. 2, 3).
Слизисто-надкостничный лоскут укладывался на место и фиксировался глухими узловыми швами. Второй этап, вскрытие имплантатов, проводили через 4—6 мес. Рентгенологически через 6 мес. граница собственной кости и ремоделированного биоматериала не определялась. У двух больных в раннем послеоперационном периоде отмечалось расхождение единичных швов. Наличие мембраны позволило полностью сохранить костнопластический материал. В дальнейшем заживление раны проходило благополучно. Имплантаты и опирающиеся на них ортопедические конструкции функционировали хорошо.
Внутрикостная трансплантация проведена у 41 человека.
Показаниями к операции были узкая альвеолярная дуга и необходимость ее смещения в вестибулярную сторону для создания правильного окклюзионного взаимоотношения. Слизистую оболочку и надкостницу рассекали по ходу альвеолярной дуги, при необходимости с вертикальными разрезами в сторону преддверья. Откидывали слизисто-надкостничный лоскут, скелетируя кость.
При помощи пьезохирургического инструмента осуществляли вертикальную остеотомию и репозицию вестибулярной стенки кнаружи. По возможности на дне образовавшегося пространства создают ложа для имплантатов и устанавливают их так, чтобы 1/2 или 1/3 тела имплантата фиксировалась в собственной кости. При значительном дефиците кости проводили только костнопластическую операцию. Образовавшиеся пустоты заполняли биоматериалом, который закрывали мембраной «Evolution».
Для данного типа операций предпочтение отдавали костнореконструктивным материалам «Apatos», «Gen-Os». Причем «Apatos» нами применялся у пациентов с 3-м и 4-м классом плотности костной ткани (по Misch), что обеспечивало повышение плотности костного регенерата в дальнейшем, а «Gen-Os» у пациентов с 1-м классом плотности костной ткани (по Misch), это позволяло получить костный регенерат меньшей плотности, что способствовало остеоинтеграции имплантатов. Через 5—6 мес. проводили вскрытие имплантатов, устанавливали супраструктуры и ортопеды осуществляли окончательное протезирование. Через 6 месяцев на рентгенограмме и РКТ определялась кость плотного строения, имплантаты окружены и плотно сращены с костной тканью. У каждого пациента успех операции составил 100 %.
Реконструкция альвеолярного сегмента верхней челюсти доступом через альвеолярный отросток с поднятием дна верхнечелюстной пазухи проведена у 52 больных.
Суть операции заключается в увеличении высоты альвеолярного отростка, поднятии дна верхнечелюстной пазухи путем введения биоматериала между ее дном и базальной костью. Показанием для такого доступа и костной пластики послужили наличие высоты базальной кости в области моляров и премоляров не менее 7—9 мм и ширина альвеолярной дуги 5 мм. Иначе говоря, уровень кости должен быть не менее 2/3 высоты имплантата. Биоматериал вводился доступом через ложе, сформированное для имплантата.
На границе с дном верхнечелюстной пазухи толщина биоматериала должна быть не менее 2—3 мм для цилиндриеского имплантата и 4—5 мм для плоского
Трапециевидный разрез проведен на 2—3 мм в сторону неба, параллельно альвеолярной дуге. Слизисто-надкостничный лоскут отведен в вестибулярную сторону. Это дало хороший обзор обеих сторон альвеолярного отростка и позволило оценить его размеры. Под контролем визиографии вводили гранулы биоматериала и легкими движениями при помощи остеотомов поднимали кортикальную пластинку дна верхнечелюстной пазухи. Перед каждым движением и сменой остеотома рану заполняли биоматериалом, утрамбовывая его, увеличивая высоту кости альвеолярного отростка и одновременно поднимая дно пазухи.
На границе с дном верхнечелюстной пазухи толщина биоматериала должна быть не менее 2—3 мм для цилиндриеского имплантата и 4—5 мм для плоского.
Проверяли состояние слизисто-надкостничного лоскута. Проводили туалет раны, внутренней части имплантата. Слизисто-надкостничный лоскут укладывали на место и фиксировали частыми глухими узловыми швами. Через 4—6 мес. имплантаты вскрывались и осуществлялось окончательное протезирование. У всех 52 человек функционирование имплантатов и ортопедических конструкций проходило хорошо. 4 пациентам спустя 1,5—2 года понадобилась замена протеза.
Реконструкция альвеолярного отростка и тела верхней челюсти доступом через дистально-латеральную стенку с поднятием дна верхнечелюстной пазухи.
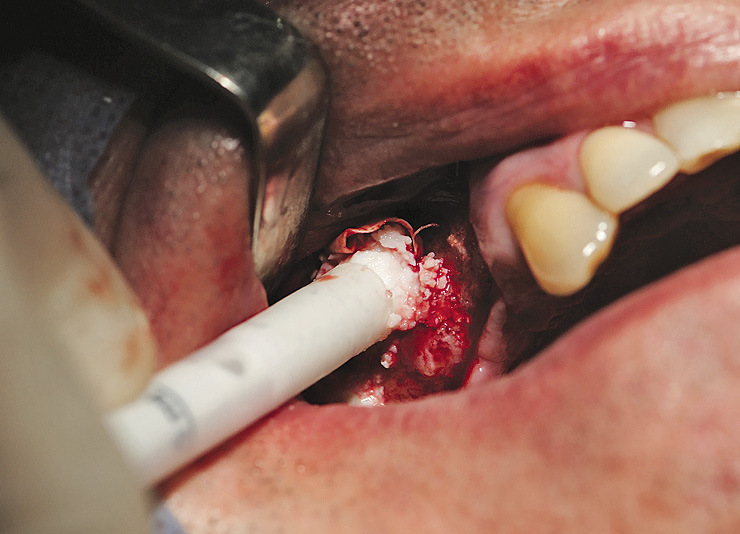
Операция показана при малом количестве кости в области моляров, пневматическом типе верхнечелюстной пазухи с низким расположением бухт, в том числе в области бугра верхней челюсти (рис. 4, 5).
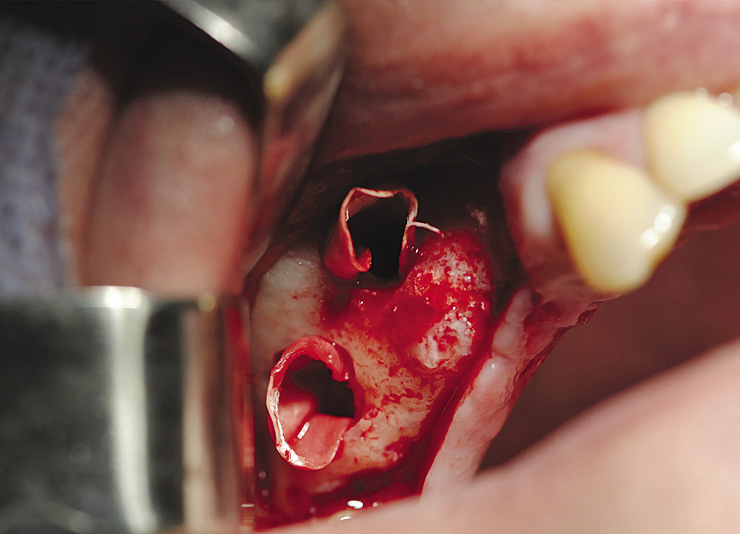
Рис. 4. Реконструкция альвеолярного отростка верхней челюсти комбинированным доступом через передне-латеральную и дистально-латеральную стенки с поднятием дна верхнечелюстной пазухи.
Вмешательство проведено у 98 больных: 62 — двухэтапное, 36 — одноэтапная костная пластика с имплантацией. Трапециевидное рассечение слизистой оболочки и надкостницы осуществляли на уровне моляров и премоляров, отступив на 2 мм от центра альвеолярной дуги в небную сторону, с боковыми разрезами по направлению к своду преддверия. Отслаивали слизисто-надкостничный лоскут. Костное окно размером 15 x 15 мм либо 20 x 20 мм создавали на 3 мм выше альвеолярной дуги, чаще на уровне верхнего края базальной кости.
И при поднятии дна верхнечелюстной пазухи, и при трансплантации необходимо создание трехмерной математической виртуальной модели по РКТ
Спереди и сзади от скулоальвеолярного гребня трепанировали дистально-латеральную стенку верхней челюсти, расширяли костное окно, отсепаровывали слизистую оболочку по дну пазухи внутрь, вверх и вперед. В образовавшееся пространство вводили биоматериал, смешав его с кровью и опилками аутокости, утрамбовывали назад, вперед и вверх. Проверив по визиографу распределение биоматериала в трех плоскостях и убедившись, что объема будущей кости хватит для имплантации, закрывали костное окно мембраной Evolution. При немедленной имплантации со стороны альвеолярной дуги формировали ложа для имплантатов и устанавливали их.
Ремоделирование всего биоматериала зависело от количества собственной кости и введенного материала. Исследование биоптата биоматериала, взятого к концу 5—6-го мес., при отсроченной имплантации показало наличие плотной неструктурированной ткани. У 14 больных окончательной минерализации материала через 12—18 мес. не происходило. Вместе с тем функционирование имплантатов было хорошим.
Из 615 установленных имплантатов 98,5 % функционировали от 2 до 4 лет, 9 были удалены через 2—3 года в связи с периимплантитом. У пациентов IV—VI групп при вмешательствах использовали материал mp3 OsteoBiol, как наиболее адаптированный для синус-лифтинга.
Проведенный нами сравнительный анализ двухэтапной и одноэтапной операций позволяет рекомендовать одновременную аугментацию кости и имплантацию.
Для выбора каждого вида вмешательства и оперативного доступа был создан алгоритм в зависимости от размеров, локализации, степени атрофии верхней челюсти, близости дна верхнечелюстной пазухи, окклюзионного взаимоотношения челюстей.
Все используемые нами биоматериалы были эффективны. Следует рекомендовать их сочетание, особенно с аутокостью. Для выбора метода аугментации на верхней челюсти очень важна комплексная диагностика. И при поднятии дна верхнечелюстной пазухи, и при трансплантации необходимо создание трехмерной математической виртуальной модели по РКТ.