Амелобластная фиброма с кальцифицирующей кистой у ребенка 8 лет
Т. Кутилли (Tommaso Cutilli)
Отделение челюстно-лицевой хирургии, Городская больница Сан-Сальваторе, Л’Акуила, Италия
Д. Колетти (Gino Coletti)
Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
М. Валид А. Фатер (Mohammad Walid A Fatayer)
Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
С. Карузо (Silvia Caruso)
Школа стоматологии Университета Л’Акуила, Италия
С. Текко (Simona Tecco)
Школа стоматологии, Университет Vita-Salute San Raffaele, Милан, Италия
Р. Гатто (Roberto Gatto)
Школа стоматологии Университета Л’Акуила, Италия
П. Леоката (Pietro Leocata)
Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
Амелобластные фибромы (АФ) являются новообразованиями одонтогенного эпителия и мезенхимальных тканей, и классифицируются как смешанные одонтогенные опухоли. Другие смешанные одонтогенные поражения, такие как амелобластные фибродонтомы и одонтомы, имеют некоторые клинические, рентгенологические и гистологические сходства с АФ. Данное новообразование встречается редко и составляет примерно 1,5–4,5% всех одонтогенных опухолей [Regezi с соавт., 1978; Cohen и Bhattacharya, 2004; Philipsen с соавт., 1997; Cargini, 2012].
Эти поражения считаются опухолями детского и подросткового возраста и практически всегда возникают в первом и втором десятилетиях жизни [Slootweg, 1981]. Было отмечено небольшое преобладание пациентов мужского пола [Philipsen с соавт., 1997; Slootweg, 1981]. Наиболее распространенным местом для опухоли является дистальный отдел нижней челюсти, за ним следует дистальный отдел верхней челюсти. Пораженный зуб может быть связан с опухолью примерно в 75% случаев [Cohen и Bhattacharya, 2004; Philipsen с соавт., 1997; Trodahl, 1972; Nasim, 2015].
Поскольку АФ может потенциально содержать различные типы тканей, которые могут повлиять на окончательный диагноз, необходимо удалить опухоль, сохранив ее целостность для точного гистологического исследования. Этим принципом следует руководствоваться также в том случае, если рентгенологически очаг поражения имеет большую протяженность. Клинический случай, приведенный ниже, показывает правильный терапевтический подход, в соответствии с принципами онкологического лечения этой редкой патологии у детей.
Клинический случай
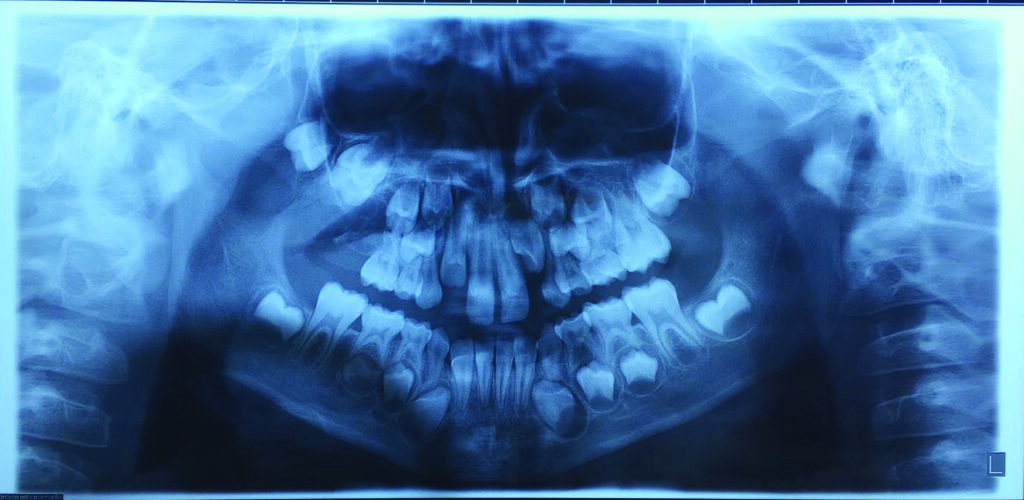
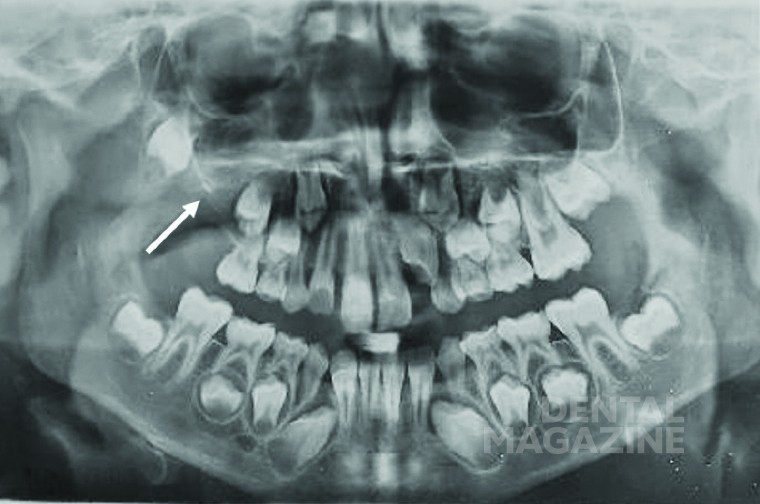
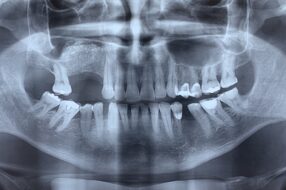
Пациентка, 8 лет, в декабре 2015 года была госпитализирована в Отделение челюстно-лицевой хирургии Университета Л’Акуила при Городской больнице Сан-Сальваторе, из-за отека в области преддверья на верхней челюсти справа. Клиническое обследование выявило отсутствие постоянного верхнего правого первого моляра. Рентгенограмма показала контрастную область в правой верхнечелюстной пазухе и смещение первого моляра в дистальном отделе верхней челюсти (рис. 1).
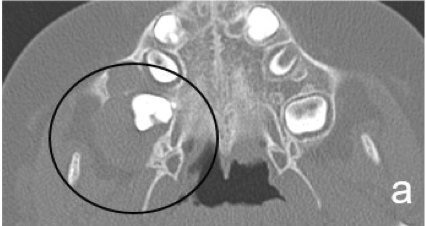
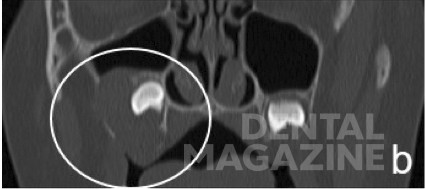
Первоначально пациентка была направлена к нам для ортодонтического лечения с проведением небного расширения, с целью вытянуть ретенированный зуб [Tecco с соавт., 2007]. Но пациентка указала на боль в дистальном отделе нижней челюсти, которая первоначально трактовалась как боль в височно-нижнечелюстном суставе [Cianetti с соавт., 2017]. Затем была назначена компьютерная томография. КТ-срезы показали образование на верхней челюсти, которое в значительной степени занимало правую верхнечелюстную пазуху, и простиралось в крыловидно-верхнечелюстную ямку с серьезной деформацией стенок верхней челюсти (рис. 2). Первоначально предполагалось, что это образование является воспалительной гранулемой [Tecco с соавт., 2018].
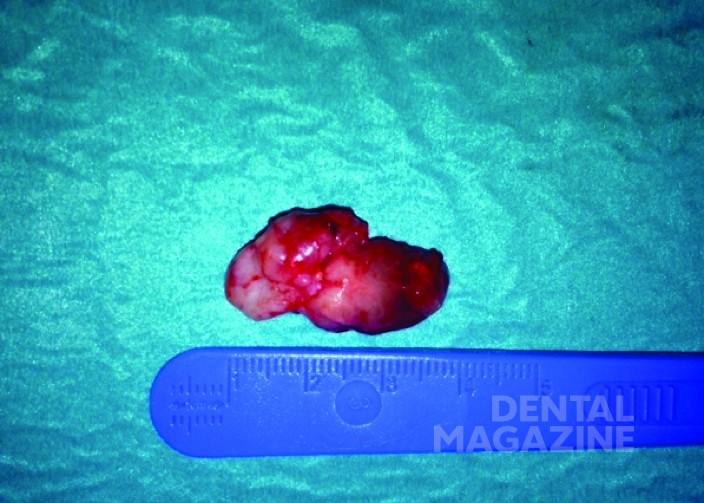
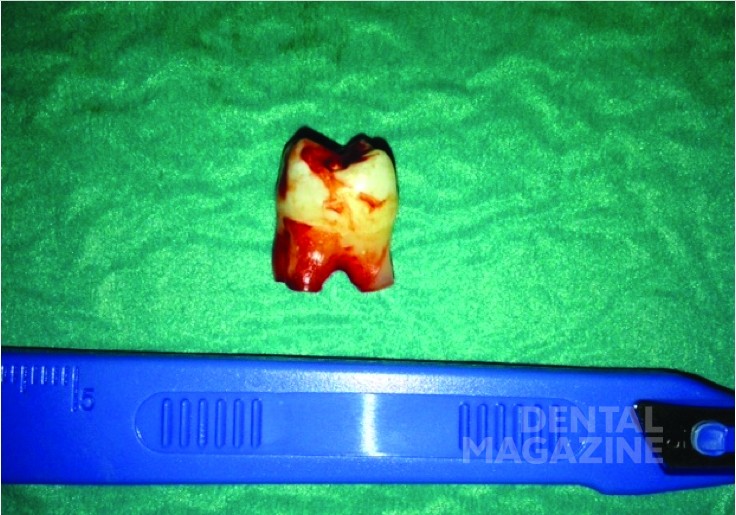
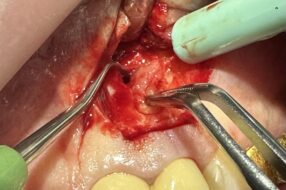
Пациентка была прооперирована под общим наркозом. Поражение энуклеировали пероральным доступом с помощью оптических инструментов. Образец был отправлен на гистопатологическое исследование. Макроскопическое исследование показало плотно-кистозное образование размером 3х1,7х1,2 см (рис. 3). Твердая часть образования была белой, в то время как кистозная часть была коричнево-белой. Твердая часть размером 1,5х0,6х0,3 см содержала коричневатое полиповидное образование. Постоянный первый моляр также был удален (рис. 4, 5).
Гистологическая характеристика
Гистологические срезы ткани, погруженной в парафин, имели толщину 4 мкм. Они были окрашены гематоксилином и эозином, а также Конго красным.
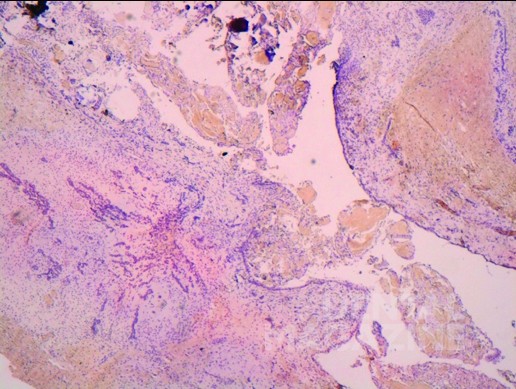
В твердой части поражения обнаружена клеточная миксоидная строма, напоминающая примитивный зубной сосочек, смешанная с многочисленными островками амелобластного эпителия, состоящего из взаимосвязанных нитей, островков и тяжей пролиферирующего одонтогенного эпителия, внутри плотной коллагеновой стромы. Тяжи в основном имели столбчатые или кубовидные клетки, расположенные по две. Периферический слой клеток показал обратную ядерную полярность и отчетливую базальную мембрану, характерную для АФ.
Были также отложения дентиноидной ткани, прилегающие к эпителиальной выстилке. В пределах примитивного зубного сосочка наблюдались эмалевые органоподобные эпителиальные островки, которые характеризуются как амелобластная фибродонтома (АФД).
Массы мертвых клеток (МК) также наблюдались в пределах амелобластного эпителия, в области АФ. Мертвые клетки — это бледные энуклеированные клетки, с однородной эозинофильной цитоплазмой и с очень четкой центральной областью, вместо базофильного ядра. Кальцификация, по-видимому, происходит в задней части МК. Только несколько одонтогенных и неодонтогенных опухолей демонстрируют присутствие этих МК в качестве характерной черты. МК типичны для кальцифицирующих одонтогенных кист (КОК), которые обычно связаны с другими одонтогенными опухолями, в основном одонтомой, и редко с АФ. Микроскопически КОК состоит из многочисленных многогранных масс эпителиальных клеток, с четко выраженным слоем столбчатых клеток, с характерной круговой кальцификацией.
Окончательный микроскопический диагноз представлял собой смешанную одонтогенную опухоль, большую часть которой можно охарактеризовать как амелобластную фиброму, с наличием участков представленных мертвыми клетками и следами амелобластной фибродонтомы. Часть гистологических срезов содержали только ткань АФ с участками КОК.
Иммуногистохимическая характеристика
Иммуногистохимическое исследование проводили с использованием системы обнаружения EnVision FLEX и Dako, с автостейнером Link 48 и иммуностейнером Dako (Agilent Technologies). Срезы обезвоживали и обрабатывали при рН6 или 9, температуре 97°С, в течение 15 минут в термостатической ванне (PT Link Dako). Наконец, срезы охлаждали в Tris (EnVision FLEX Wash Buffer) и вводили в иммуностайнер, а затем подвергали компьютеризированному циклу обработки. Затем они были окрашены гематоксилином Карацци, промыты в воде и обезвожены.
Для подтверждения гистологического диагноза использовали следующие маркеры: CK14, CK19, CD138, Ki67, S-100, GFAP, CK5-6, коллаген IV, p63, EGFR и p53. Результаты иммуногистохимического окрашивания были следующими:
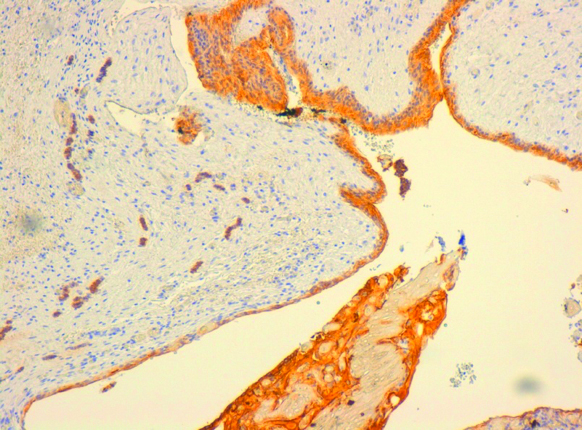
- CK14: сильное окрашивание наблюдалось в эпителии АФ, а также в элементах КОК (рис. 6);
- CK19: окрашивание наблюдалось в эпителиальных элементах АФ, но CK19 был более сильно выражен в элементах КОК (рис. 7);
- CD138: этот маркер также известен как Синдекан-1. Сильное окрашивание наблюдалось в эпителиальных элементах АФ, а также в элементах КОК;
- Ki67: экспрессия этого маркера была положительной примерно в 1% амелобластных клеток и элементов КОК. Слабая экспрессия этого маркера указывала на низкую пролиферативную скорость, дополнительно обосновывая доброкачественный характер;
- S-100: сильное окрашивание этого маркера обычно наблюдается в клетках Лангерганса и Шванна. В очаге поражения было несколько S-100 положительных клеток в очагах эпителиальных компонентов, как в области АФД, так и в области АФ;
- GFAP (глиальный фибриллярный кислый белок): окрашивание не выявлено (отрицательная экспрессия);
- CK5-6: сильное окрашивание было в эпителиальных элементах АФ, а также в элементах КОК (рис. 8);
- Collagen IV: положительное окрашивание;
- p63: чрезвычайно сильное окрашивание было в эпителиальных элементах АФ, меньшее окрашивание было в элементах КОК;
- EGFR: сильное окрашивание наблюдается в эпителиальных элементах и элементах КОК;
- p53: окрашивание не выявлено (отрицательная экспрессия).
Обсуждение
В данной статье представлен правильный терапевтический подход в соответствии с принципами онкологического лечения редкой патологии у пациентов детского возраста и данными гистологической и иммуногистохимической характеристик.
АФ впервые была зарегистрирована Крузе в 1891 году, и она считается редкой доброкачественной смешанной одонтогенной опухолью с относительной частотой от 1,5% до 4,5% [Philipsen с соавт., 1997].
АФ обычно считается истинной смешанной одонтогенной опухолью, в которой как эпителиальные, так и эктомезенхимальные компоненты являются неопластическими. Действительно, эти образования показывают истинные неопластические особенности по отношению к другим смешанным одонтогенным опухолям, которые лучше классифицируются как гамартомы и, в отличие от АФ, имеют мало шансов на рецидив или злокачественную трансформацию [Slootweg, 1981; Nelson и Folk, 2009].
В пределах наших знаний, появление мертвых клеток в АФ, как и в КОК, является еще более редким событием: в международной литературе есть только семь случаев, в которых мертвые клетки встречаются в АФ, но все эти ранее сообщенные случаи были связаны с типичными КОК [Arora с соавт., 2015]. В данном случае очаговые зоны дифференцировки МК наблюдаются в пределах неопластического эпителия, в зоне АФ. Очаг поражения, описанный в нашем случае, был в основном солидным, с характерными признаками АФ. Кроме того, в нескольких областях был обнаружен амелобластный эпителий с признаками мертвых клеток и кальцификатами.
В литературе сообщается об уникальном случае у ребенка, 3,5 года, с солидным поражением, которое включало одонтогенные нити эпителия, островки и миксоидную эктомезенхиму, с очаговыми областями дифференцировки МК и кальцификации, связанными с неопластическим эпителием [Arora с соавт., 2015]. Сравнение иммуноистохимического окрашивания зон АФ и КОК показало, что маркер p63 вызывал чрезвычайно сильное окрашивание в эпителиальных элементах АФ, а более низкая степень окрашивания была в элементах КОК. В слизистой оболочке полости рта человека р63 в основном ограничивается базальным и пара-базальным слоями нормального эпителия [Gonçalves с соавт., 2012]. Поскольку одонтогенные кистозные поражения в основном имеют эпителиальное происхождение, белок p63 может быть сильно выражен во время их роста и прогрессирования, что указывает на сохранение и целостность кистозной одонтогенной эпителиальной выстилки и, таким образом, способствует сохранению поражения.
Ближайшие события
Остается неизвестным, развиваются ли вторично те КОК, которые имеют признаки других одонтогенных опухолей, или они сами являются вторичными явлениями в ранее существовавших одонтогенных опухолях [Arora с соавт., 2015]. В нашем случае более низкое окрашивание маркера p63 в элементах КОК, по-видимому, указывает на то, что это вторичное явление по отношению к ранее существовавшей одонтогенной опухоли.
Для того, чтобы в дальнейшем охарактеризовать поражения, следующие маркеры были использованы для иммуногистохимического исследования: CK14, CK19, CD138, Ki67, S-100, GFAP, CK5-6, Collagen IV, EGFR и p53. Цитокератин 14 и 19 окрашивают одонтогенный эпителий на всех стадиях развития зубов, включая фазы зубной пластинки и звездчатого ретикулума, хотя Цитокератин 19 более заметен на поздней стадии развития зубов [Crivelini с соавт., 2003; Домингес с соавт., 2000]. Таким образом, сильная экспрессия, которую мы обнаружили для CK14 и CK19 в эпителиальных клетках, подтвердила одонтогенную природу поражения. Маркер CD138 (также известный как Синдекан-1) в нашем случае показал сильное окрашивание эпителиальных элементов АФ, а также элементов КОК. Положительная экспрессия Синдекана-1 часто встречается в эпителии эмали во время созревания, и является общей чертой как стромальных клеток, так и внеклеточного матрикса, в то время как отсутствие экспрессии Синдекана-1 в стромальных клетках и внеклеточном матриксе можно рассматривать как критический фактор для канцерогенеза и локальной инвазивности внутрикостных амелобластом [Leocata с соавт., 2007].
Слабая экспрессия Ki67 в нашем поражении указывала на низкую скорость пролиферации этой опухоли, что подтверждает ее доброкачественную природу [Sano с соавт., 1998]. В очагах эпителиальных компонентов как в области АФД, так и в области АФ было несколько маркер-положительных клеток S-100, в то время как мезенхимальные клетки, характеризующиеся дендритной или веретенообразной формой, были положительными для белка S-100, как в области АФД, так и в области АФ [Takeda с соавт., 2000]. Сильное окрашивание этого маркера обычно наблюдается в клетках Лангерганса и Шванна. Положительное окрашивание для маркера GFAP наблюдалось только в эпителиальной мезенхимальной ткани, что свидетельствует о формировании незрелого дентина. Это наблюдалось в различном количестве оххваченных клеток в АФД. В АФ не было обнаружено GFAP-положительных клеток [Heikinheimo с соавт., 1992].
Однако окрашивание GFAP было отрицательным в других мезенхимальных и эпителиальных тканях. В нашем поражении положительное окрашивание было выражено для Collagen IV. Коллаген IV типа — один из компонентов базальной мембраны, которая является организованным внеклеточным матриксом, разделяющим эпителий и смежную строму соединительной ткани. Отсутствие или разрыв базальной мембраны коррелирует с агрессивным поведением опухолей. Согласно Heikinheimo с соавт. [1992], отсутствие ламинина и коллагена IV типа в базальной мембране и присутствие фибронектина, содержащего онкофетальный домен во внеклеточном матриксе амелобластомы, может коррелировать с их агрессивным поведением.
Рецептор эпидермального фактора роста (маркер EGFR) локализован на поверхностных мембранах многих типов клеток и в основном участвует в пролиферации клеток [Vered с соавт., 2003]. EGFR часто присутствует в эпителиальных элементах зародыша зуба человека, а также в кистозных одонтогенных поражениях и одонтогенных опухолях, что предполагает его участие в нормальном одонтогенезе и развитии этих поражений [Li с соавт., 1997; Tanikawa и соавт., 1999].
В нашем случае окрашивание для маркера р53 не было выявлено. Некоторые исследования связывали инфекцию высокого риска ВПЧ-16 (HR-HPV16) с чрезмерной экспрессией или мутацией гена p53 при раке полости рта [Cutilli с соавт. 2016; Cutilli и соавт., 2016(б)]. Опухоль КОК, также известная как опухоль Пиндборга, характеризующаяся наличием амилоидной ткани, в нашем случае не была обнаружена. Клиническое, патологическое и биологическое поведение АФ требует особого внимания, особенно когда это касается детей. Радикальное хирургическое иссечение с удалением пораженных зубов является методом выбора.
Частота повторения варьируется среди источников, но считается низкой [Leider с соавт., 1992; Altini и соавт., 1985]. Однако, возможность злокачественной трансформации АФ в амелобластную фибросаркому хорошо документирована [Leider с соавт., 1992; Altini и соавт., 1985]. По этой причине регулярное наблюдение является обязательным. Очаг поражения может быть удален путем радикальной энуклеации, энуклеации со стерилизацией костных краев с помощью химических веществ (жидкий азот и др.) или механически (бор).
Источник: www.ejpd.eu
- Altini M, Thompson SH, Lownie JF, Berezowski BB. Ameloblastic sarcoma of the mandible. J Oral Maxillofac Surg 1985;43:789-794.
- Arora M, Dave A, Shetty V, Saluja P. Ameloblastic fibroma with ghost cell differentiation and calcification: a unique case report. J Cancer Res Ther 2015;11(4):1033.
- Cargini P, Fidanza F, Facente MV, Sgolastra F, Gatto R, Cutilli T. Gingival myofibroma. A case report. Eur J Paediatr Dent 2012; 13 (1): 81-83.
- Cianetti S, Lombardo G, Lupatelli E, Pagano S, Abraha I, Montedori A, Caruso S, Gatto R, De Giorgio S, Salvato R.Dental fear/anxiety among children and adolescents. A systematic review.Eur J Paediatr Dent 2017 Jun;18(2):121-130.
- Cohen DM, Bhattacharyya I. Ameloblastic fibroma, ameloblastic fibro-odontoma, and odontoma.Oral Maxillofac Surg Clin North Am 2004;16:375-384.
- Crivelini MM, de Araujo VC, de Sousa SOM, de Araujo NS. Cytokeratins in epithelia of odontogenic neoplasms. Oral Dis 2003;9(1):1-6.
- Cutilli T, Leocata P, Dolo V, Altobelli E. The Association between p53 status, human papillomavirus infection, and overall survival in advanced oral cancer after resection and combination systemic treatment. Brit J Oral Maxillofacial Surg 2016 (a); 54:198–202.
- Cutilli T, Leocata P, Dolo V, Altobelli E. p53 as a prognostic marker associated with the risk of mortality for oral squamous cell carcinoma. Oncol Letters 2016 (b);12:1046-1050.
- Domingues MG, Jaeger MM, Araujo VC, Araujo NS. Expression of cytokeratins in human enamel organ. Eur J Oral Sci 2000;108(1):43-47.
- Gonçalves CK, Fregnani ER, Leon JE, Silva-Sousa YT, Perez DE. Immunohistochemical Expression of p63, Epidermal Growth Factor Receptor (EGFR) and Notch-1 in Radicular Cysts, Dentigerous Cysts and Keratocystic Odontogenic Tumor. Braz Dent J 2012;23(4):337-343.
- Heikinheimo K, Morgan PR, Happonen RP. Distribution of extracellular matrix proteins in odontogenic tumours and developing teeth. Cell Pathol 1992;61(2):101-109.
- Kruse A. On the development of cystic tumors in the mandible. Arch Path Anat 1891;124:137-148.
- Leider AS, Nelson JF, Trodahl JN. Ameloblastic fibroma. Oral Surg 1972;33:559-569.
- Leocata P, Villari D, Fazzari C, Lentini M, Fortunato C, Nicòtina A. Syndecan-I and wingless-type protein-I in human ameloblastomas. J Oral Path Med 2007;36:394-399.
- Li TJ, Browne RM, Matthews JB. Immunocytochemical expression of growth factors by odontogenic jaw cysts. Mol Pathol 1997;50:21-27.
- Nelson BL, Folk GS. Ameloblastic fibroma. Head Neck Pathol 2009;3:51-53.
- Philipsen HP, Reichart RP, Pratorius F. Mixed odontogenic tumors and odontomas: considerations on interrelationship. Review of the literature and presentation of 134 new cases of odontomas. Oral Oncol 1997;33:86-99.
- Regezi JA, Kerr DA, Courtney RM. Odontogenic tumors: analysis of 706 cases. Oral Surg 1978;36:771-778.
- Sano K, Yoshida SI, Ninomiya H et al. Assessment of growth potential by MIB-1 immunohistochemistry in ameloblastic fibroma and related lesions of the jaws compared with ameloblastic fibrosarcoma. J Oral Path and Med 1998;27(2):59-63.
- Slootweg PJ. An analysis of the interrelationship of mixed odontogenic tumors—ameloblastic fibroma, ameloblastic fibro-odontoma, and the odontomas. Oral Surg Oral Med Oral Pathol 1981;51:266-276.
- Takeda Y, Sato H, Satoh M, Nakamura SI, Yamamoto H. Immunohistochemical expression of neural tissue markers (neu-ron-specific enolase, glial fibrillary acidic protein, S100 protein) in ameloblastic fibrodentinoma: a comparative study with ameloblastic fibroma. Pathol Int 2000;50(8):610-615.
- Tanikawa Y, Bawden JW. The immunohistochemical localization of phospholipase cγ and the epidermal growth-factor, platelet-derived growth-factor and fibroblast growth-factor receptors in the cells of the rat molar enamel organ during early amelogenesis. Arch Oral Biol 1999;44:771-780.
- Tecco S, Caputi S, Festa F. Evaluation of cervical posture following palatal expansion: a 12-month follow-up controlled study. Eur J Orthod. 2007 Feb;29(1):45-51. Epub 2006 Sep 6. Erratum in: Eur J Orthod. 2008 Feb;30(1):110.
- Tecco S, Nota A, Caruso S, Primozic J, Marzo G, Baldini A, Gherlone EF. Temporomandibular clinical exploration in Italian adolescents. Cranio. 2017 Oct 26:1-8. doi: 10.1080/08869634.2017.1391963. [Epub ahead of print] PMID: 29072541.
- Tecco S, Caruso S, Nota A, Leocata P, Cipollone G, Gatto R, Cutilli T. Bilateral Central Giant Cell Granuloma of the mandibular angle in three females from the same family. Head Face Med. 2018 Sep 4;14(1):14.
- Trodahl JN. Ameloblastic fibroma. A survey of cases from the armed Forces Institute of Pathology. Oral Surg Oral Med Oral Pathol 1972;33:547-558.
- Vered M, Shohat I, Buchner A. Epidermal growth factor receptor expression in ameloblastoma. Oral Oncol 2003;39:13.
- Nasim VS, Perumal P. Oral epidermoid cyst. A case report. Eur J Paediatr Dent 2014; 15 (2) Suppl.: 247-249.
Томмазо Кутилли, Отделение челюстно-лицевой хирургии, Городская больница Сан-Сальваторе, Л’Акуила, Италия
T. Cutilli, Maxillofacial Surgery Operative Unit, San Salvatore City Hospital, L’Aquila, Italy
Джино Колетти Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
G. Coletti, Pathology Operative Unit, San Salvatore City Hospital, L’Aquila, Italy
Мохаммад Валид А. Фатер, Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
M. Walid A. Fatayer, Pathology Operative Unit, San Salvatore City Hospital, L’Aquila, Italy
Сильвия Карузо, Школа стоматологии Университета Л’Акуила, Италия
S. Caruso, Dental School, Department of Life, Health and Environmental Sciences, University of L’Aquila, Italy
Симона Текко, Школа стоматологии, Университет Vita-Salute San Raffaele, Милан, Италия
S. Tecco, Dental School, Vita-Salute San Raffaele University, Milan, Italy
Рoберто Гатто, Школа стоматологии Университета Л’Акуила, Италия
R. Gatto, Dental School, Department of Life, Health and Environmental Sciences, University of L’Aquila, Italy
Пьетро Леоката, Патологоанатомическое отделение, Городская больница Сан-Сальваторе, Л’Акуила, Италия
P. Leocata, Pathology Operative Unit, San Salvatore City Hospital, L’Aquila, Italy
Very large Ameloblastic Fibroma with Calcifying Odontogenic Cyst in an 8-year-old child. Histological and immunohistochemical characterization
Аннотация. Амелобластная фиброма (АФ) является редкой одонтогенной опухолью, которая может показывать агрессивное поведение и иметь потенциал для злокачественной трансформации. Дифференцировка мертвых клеток (МК) в пределах АФ встречается крайне редко. В международной литературе есть только семь случаев, в которых мертвые клетки встречаются в АФ. В этом исследовании мы сообщаем о случае пациентки, 8 лет, с плотно-кистозным новообразованием, размерами 3х1,7х1,2 см, охарактеризованным как смешанная одонтогенная опухоль, большую часть которой можно охарактеризовать как амелобластную фиброму, с наличием участков представленных мертвыми клетками и следами амелобластной фибродонтомы. Часть гистологических срезов содержали только ткань АФ с участками кальцифицирующей одонтогенной кисты. Также было проведено иммуногистохимическое исследование опухоли.
Annotation. Ameloblastic fibroma (AF) is an uncommon odontogenic tumour that may present an aggressive behaviour and may have potential for malignant transformation. Ghost cell (GC) differentiation within AF is extremely rare. There are only seven cases in the international literature in which ghost cells are found in AF. In this study, we report a case of a 8-year-old female child with a cystic-solid mass, measuring 3 x 1.7 x 1.2 cm, characterised by mixed odontogenic tumour, with AF in most of the lesion, with areas characterised by GC, while ameloblastic and ameloblastic fibrodontoma areas were also detected. Other histological sections showed only AF tissue, with areas of Calcifying Odontogenic Cyst. The immunohistochemical characterisation of the lesion was also performed. A comparative table of the immunoistochemical staining of the AF and COC areas revealed some differences in the expression of markers.
Ключевые слова: Амелобластная фиброма; кальцификация; КОК; мертвые клетки.
Keyword: Ameloblastic fibroma; calcification; COC; ghost cells.