Диагностическое значение анализа матриксных металлопротеиназ у детей с расщелиной губы и неба
А. Э. Марданов
аспирант кафедры стоматологии детского возраста и ортодонтии ФГБОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России
А. А. Мамедов
д. м. н., профессор, заслуженный врач России, заведующий кафедрой стоматологии детского возраста и ортодонтии ФГБОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России
А. А. Рагимов
д. м. н., профессор, начальник центра крови первого МГМУ им. Сеченова
Н. Г. Дашкова
д. м. н., профессор, заведующая лабораторией — врач клинической лабораторной диагностики
А. В. Матвеев
врач КЛД межклинической иммунологической лаборатории
Т. Т. Османова
к. м. н., ассистент кафедры стоматологии детского возраста и ортодонтии ФГБОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России
Актуальность проблемы
По статистическим данным, в Российской Федерации врожденная патология челюстно-лицевой области занимает 3—5-е место среди врожденных пороков развития человека. В России в среднем рождается один ребенок с расщелиной верхней губы и неба на 600—1000 новорожденных [4].
Врожденные пороки развития оставляют отпечаток на всех этапах жизни индивидуума, а врожденная патология челюстно-лицевой области — в большей степени на психологическом состоянии. Оперативное вмешательство не всегда позволяет достичь желаемого результата. Расщелина губы и неба является проблемой не только для ребенка, но и для его родителей.
Анатомические и физиологические нарушения, сопутствующие расщелине губы и неба, приводят к нарушению жизненно важных для ребенка функций, таких как сосание, глотание, жевание, дыхание, нарушению речевой артикуляции. Расщелина губы и неба является причиной развития у ребенка комплекса неполноценности [1]. На фоне тяжелого состояния ребенка с РГН существуют дополнительные функциональные нарушения, связанные с пороками развития других органов и систем [11].
Генетически детерминированное нарушение миграции мезенхимы объясняет формирование множественных врожденных пороков развития организма ребенка, выявляемых после рождения. Данный процесс обозначается термином «соединительнотканная дисплазия». Соединительнотканная дисплазия формирует внешние фенотипические признаки данного порока и изменение развития внутренних органов [2].
На сегодняшний день существует множество мнений о сроках проведения оперативного вмешательства у детей с РГН. Оперативное вмешательство на твердом и мягком небе порождает аналогичные споры в связи с возможным развитием дефектов и деформаций верхней челюсти.
Пристальное внимание в последние годы обращено на изучение семейства матриксных металлопротеиназ (MMП) — энзимов, способных расщеплять почти все компоненты внеклеточного матрикса соединительной ткани. Они играют важную роль как в физиологических процессах (морфогенез, репродукция, эмбриональное развитие, ремоделирование тканей), так и при патологии: злокачественном росте, сердечно-сосудистых заболеваниях, соединительнотканной дисплазии [3].
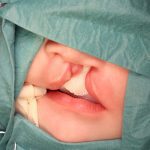
- Зоны биопсии при расщелине губы (рис 1а)
- Зоны биопсии при расщелине губы (рис. 1б)
На наш взгляд, не вызывает сомнения факт участия MMП в формировании губы и неба, но более объективную информацию о роли MMП можно получить, изучая изменение их содержания не только в системном кровотоке, но и непосредственно в мягких тканях зоны дефекта, а также можно сделать выводы о состоянии соединительной ткани макроорганизма при различных формах патологии расщелины верхней губы и неба при сравнении полученных результатов.
Морфогенез верхней губы и неба представляет собой сложный процесс, связанный с жестко регламентированным взаимодействием между собой мезенхимальных и эпителиальных клеток. Генетические исследования доказывают роль активности матриксных металлопротеиназ и их ингибиторов в процессе формирования губы и неба [6].
Семейство ММП состоит из более чем 20 секретируемых или связанных с поверхностью клетки цинкзависимых эндопептидаз, субстратами которых помимо большинства компонентов внеклеточного матрикса могут быть также другие протеазы, хемотаксические молекулы, латентные формы факторов роста, растворимые и мембранно-ассоциированные белки, связывающие факторы роста [13].
Активность ММП в межклеточном пространстве специфически подавляется тканевыми ингибиторами (ТИМП) — структурно родственными белками, три из которых (ТИМП-1, 2 и 4) секретируются в растворимой форме, а один (ТИМП-3) связан с внеклеточным матриксом [12].
Матриксные металлопротеиназы (ММП) регулируют множество процессов, происходящих в клетках экстрацеллюлярного матрикса, таких как морфогенез, репродукция, тканевая резорбция, ангиогенез, апоптоз и т. д. Снижение или увеличение активности сопутствует многим заболеваниям человека (опухоли, фиброзирующие заболевания сердца, легких, печени, почек, артрит, язвенная болезнь желудка и т. д.) [10].
ММ2, ММП3 играют важную роль в развитии неба. Brown et al. (2002) обнаружил возрастание ММП-2 с помощью иммуногистохимического анализа на протяжении формирования неба у мышей.
Экспрессия ММП-9 во время заживления на коже ведет к образованию рубцов [9]. Baliver et al. (2001) обнаружил выборочное выделение ММП-9 в зоны оссификации по срединной линии развивающейся верхней челюсти.
Экспрессия ММП-9 выше в тканях пациентов, оперативное вмешательство у которых производилось в ранние сроки, в сравнении с пациентами, у которых операция проводилась в 2—3 месяца, но разница была незначительной [7].
Для заживления повреждений кожи требуются ММП, характерной чертой которых является способствование рубцеобразованию. Семейство коллагенов — важный компонент экстрацеллюлярного матрикса раны и основная мишень для активности ММП [9].
Контроль ММП и их деятельность вызывают большой интерес в качестве возможной терапевтической мишени. Изучение уровня ММП в тканях расщелины губы и неба позволит нам расширить знания о механизмах развития расщелины губы и неба. Изучение уровня матриксных металлопротеиназ и их ингибиторов также позволит нам определить состояние соединительной ткани у пациентов с расщелиной губы и неба. Знание об уровне матриксных металлопротеиназ при разных формах и степени тяжести патологии позволит скорректировать план лечения, что приведет к лучшей реабилитации детей с расщелиной губы и неба.
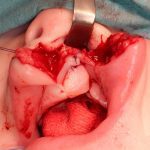
- Зоны биопсии во время оперативного вмешательства при уранопластике (рис. 2а)
- Зоны биопсии во время оперативного вмешательства при уранопластике (рис. 2б)
Цель исследования — повышение эффективности лечения детей с расщелиной губы и неба за счет раннего подхода к оперативному вмешательству через изучение уровня матриксных металлопротеиназ в мягких тканях.
Материалы и методы
Клиническое обследование и сбор материала для иммуноферментного анализа на содержание ММП-2, ММП3, ТИМП-2, TGFβ2 в биоптатах осуществлялись в Научном центре здоровья детей г. Москвы у пациентов, поступивших с 2013 по 2016 год.
В исследовании приняли участие с согласия родителей или представителей все пациенты с расщелиной губы: расщелиной губы и неба односторонней, расщелиной губы и неба двусторонней, расщелиной неба частичной.
Пациенты для исследования подбирались без ограничений по полу и возрасту, по весу, по типу родов и вскармливанию и сопутствующей патологии. Всего приняли участие в исследовании 84 пациента, из них девочек 35 (42 %), мальчиков 39 (58 %). Из 84 пациентов расщелина губы была у 64 пациентов, расщелина неба — у 75 пациентов, в том числе односторонняя у 34, двусторонняя у 35 и частичная расщелина неба у 7. Расщелина губы и неба наблюдалась у 57 (68 %) пациентов из 84. Расщелина губы — у 8 пациентов (7 %).
В исследовании приняли участие дети, родившиеся в срок, — 53 (63 %) — и преждевременно: 31 (27 %), в том числе при помощи кесарева сечения — 8 (10 %).
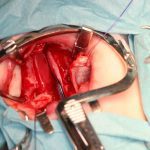
Всем пациентам было проведено оперативное вмешательство: хейлопластика, уранопластика или хейлоуранопластика в зависимости от установленного диагноза. Уранопластика была проведена в 47 случаях, а хейлопластика — в 37 случаях. Также повторное взятие образца материала для исследования было проведено у пациентов, госпитализированных для проведения уранопластики после первичной хейлопластики. Оперативное вмешательство проводилось в операционной Научного центра здоровья детей г. Москвы.
Для проведения иммуноферментного анализа нужно было получить информированное согласие родителей, так как нам необходимо было проводить биопсию мягких тканей. Для проведения иммуногистохимического анализа нужно было провести биопсию мягких тканей у всех 84 пациентов. У каждого пациента с расщелиной губы и неба биопсия была проведена дважды (рис. 1, 2). Первая биопсия была проведена в области патологии, вторая — вне зоны патологии.
Вторая биопсия была проведена вне зоны патологии в связи с тем, что ткань в этой области не изменена патологическим состоянием и структура ее не нарушена, одновременно с этим вторая биопсия являлась контролем в проводимом иммуногистохимическом анализе. Размер мягких тканей, полученных в ходе биопсии, составлял приблизительно 2 на 2 миллиметра, или размер в спичечную головку.
Образцы мягких тканей, полученные в ходе биопсии, помещались в полипропиленовые пробирки с 1 мл физиологического раствора во время операции и сразу же помещались в холодильник и хранились при температуре 2—8°. На пробирках делали отметку со знаком плюс или минус, где плюс означал образец из зоны патологии, а минус — образец, взятый вне зоны патологии. Также на пробирке делали запись фамилии пациента и инициалов с клиническим диагнозом. Холодильник располагался в лаборатории патологический физиологии Научного центра здоровья детей. Из материала, взятого в ходе биопсии, получали супернатант в кратчайшие сроки. Супернатант хранился при температуре -80°. Срок хранения материала составлял от трех месяцев до трех лет. У пациентов, принимавших участие в исследовании, из истории болезни была выписана информация приемного отделения, информация об оперативном вмешательстве, информация первичного обследования, анамнез жизни, анамнез заболевания, данные при рождении. Полученная информация систематизировалась в таблице.
Для нашего исследования необходимо было приготовление супернатанта. Супернатант нужно было приготовить в кратчайшие сроки после оперативного вмешательства. Приготовление супернатанта проводилось в течение 1—3 дней с момента оперативного вмешательства. Такой подход способствовал получению более достоверных результатов. После получения супернатанта в нем было определено количество белка на мл объема. Для дальнейшего исследования штатив с образцами был отправлен в Центр крови Первого Московского государственного медицинского университета им. И. М. Сеченова в переносном холодильнике.
Для иммуноферментного анализа были использованы реактивы ведущих мировых производителей, такие как Human TIMP-2 Quantikine ELISA Kit — RnD Systems, Human MMP-2 Quantikine ELISA Kit — RnD Systems, Bio-Plex Pro TGF-β Panel, 3-Plex Bio-Rad Laboratories, AESKULISA MMP3. Принцип метода заключался в следующем и был аналогичным для ММП3, ММП2, ТИМП2, TGFβ2.
Антитела, специфичные к ММП3, ММП2, ТИМП2, TGFβ2, сорбированы в ячейках планшета. ММП3, ММП2, ТИМП2, TGFβ2 образцов, стандартов и контрольных образцов связывается с антителами в ячейках планшета.
Добавляемые конъюгаты биотинмоноклональные анти-ММП3, ММП2, ТИМП2, TGFβ2 — антитела связывают ММП3, ММП2, ТИМП2, TGFβ2, захваченные первыми антителами. После инкубации и промывки планшета из ячеек удаляются несвязавшиеся биотиновые конъюгаты и в ячейки добавляются конъюгаты стрептавидин-пероксидаза, связывающие биотин, конъюгированный с ММП3, ММП2, ТИМП2, TGFβ2.
Промывка осуществляется аппаратом фирмы BIO-RAD. После инкубации и промывки из ячеек удаляются несвязавшиеся стрептавидиновые конъюгаты, в ячейки добавляется субстратный раствор, который взаимодействует с ферментным комплексом с образованием окрашенного раствора. Реакция останавливается добавлением кислоты. Интенсивность окраски, измеренная на длине волны 450 нм, прямо пропорциональна концентрации ММП3, ММП2, ТИМП2, TGFβ2, присутствующего в образцах.
Концентрация ММП3, ММП2, ТИМП2, TGFβ2 в образцах определяется по стандартной кривой, построенной по 6 приготовленным разведениям стандарта. Постройка кривой осуществлялась программным обеспечением, входящим в комплект к спектрофотометру фирмы BIO-RAD.
Иммуноферментный анализ матриксных металлопротеиназ 2
Установлено, что при РГН количество ММП2 в мягких тканях отличается в зоне патологии от количества в зоне без патологии. Наблюдается достоверный рост по всем рассматриваемым ферментам от небольшого увеличения до увеличения в несколько раз. Широкий разброс объясняется различным состоянием соединительной ткани при разных видах патологии, тяжестью общего состояния при различных типах РГН, травматичностью и количеством белка в образце.
Таблица №1. Значения медианы содержания ММП2 в мягких тканях при различных типах патологии РГН
Значения ММП2 из зоны расщелины составляют от 0,07 до 26,83 нг/мл, где среднее значение равно 1,57 нг/мл, 75 % значений меньше или равно 4,29 нг/мл, 25 % равно или ниже 0,45нг/мл. Содержание ММП2 в зоне патологии колебалось от 0,074 нг/мл до 26,829 нг/мл.
ММП2 из зоны без патологии имеет значения от 0,02 до 20,17 нг/мл, где среднее значение равно 0,59 нг/мл, 75 % значений меньше или равно 2,05 нг/мл, 25 % равно или ниже 0,30 нг/мл (Таблица №1).
Таким образом, по результатам проведенного иммуноферментного анализа ММ2 в мягких тканях при различных типах РГН мы сделали следующие выводы:
- Экспрессия ММП2 достоверно повышалась при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии.
- Наибольшей экспрессия ММП2 была при двусторонней расщелине губы и неба, наименьшей — при частичной расщелине губы, при которой показатели ММП2 в мягких тканях в зоне патологии лишь незначительно увеличивались.
Иммуноферментный анализ матриксных металлопротеиназ 3
В биопсии всех прооперированных детей наблюдалось разное по степени выраженности содержания ММП3. Также в супернатанте содержалось разное количество белка. Расчеты содержания ММП3 велись с учетом отношения количества биохимичетских показателей к количеству белка. Соответствующие расчеты были проведены и для материала, полученного в ходе биопсии из зоны с патологией, для сравнения с зоной без патологии.
Таблица №2. Значения медианы содержания ММП3 в мягких тканях при различных типах РГН
Значения ММП3 из зоны расщелины составляют от 0,05 до 16,48 нг/мл, где среднее значение равно 1,45 нг/мл, 75 % значений меньше или равно 3,53 нг/мл, 25 % равно или ниже 0,50 нг/мл. Содержание ММП3 из зоны без патологии имеет значения от 0,02 до 13,38 нг/мл, где среднее значение равно 0,72 нг/мл, 75 % значений меньше или равно 1,78 нг/мл, 25 % равно или ниже 0,21 нг/мл (Таблица №2).
Таким образом, по результатам проведенного иммуноферментного анализа ММ3 в мягких тканях при различных типах РГН мы сделали следующие выводы:
- Экспрессия ММП3 достоверно повышалась при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии.
- Наибольшей экспрессия ММП3 была при двусторонней расщелине губы и неба, наименьшей — при частичной расщелине губы, при которой показатели ММП2 в мягких тканях в зоне патологии лишь незначительно увеличивались.
Иммуноферментный анализ матриксных тканевых ингибиторов матриксных металлопротеиназ 2
В биопсии всех прооперированных детей наблюдалось разное по степени выраженности содержания, ТИМП2. Также в супернатанте содержалось разное количество белка. Расчеты содержания ТИМП2 велись с учетом отношения количества биохимических показателей к количеству белка. Соответствующие расчеты были проведены и для материала, полученного в ходе биопсии из зоны с патологией, для сравнения с зоной без патологии.
Таблица №3. Значения медианы содержания ТИМП2 в мягких тканях при различных типах РГН
Содержание ТИМП2 из зоны расщелины имеет значения от 0,04 до 34,25 нг/мл, где среднее значение равно 3,29 нг/мл, 75 % значений меньше или равно 8,75 нг/мл, 25 % равно или ниже 0,45 нг/мл.
Показатели ТИМП2 из зоны без патологии имеют значения от 0,02 до 23,75 нг/мл, где среднее значение равно 1,38 нг/мл, 75 % значений меньше или равно 5,91 нг/мл, 25 % равно или ниже 0,36 нг/мл (Таблица №3).
Таким образом, по результатам проведенного иммуноферментного анализа ТИМП2 в мягких тканях при различных типах РГН мы сделали следующие выводы:
- Экспрессия ТИМП2 достоверно повышалась при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии.
- Наибольшей экспрессия ТИМП2 была при двусторонней расщелине губы и неба, наименьшей — при частичной расщелине губы.
Иммуноферментный анализ тканевого фактора роста β-2
В биопсии всех прооперированных детей наблюдалось разное по степени выраженности содержания TGFβ2. Также в супернатанте содержалось разное количество белка. Расчеты содержания TGFβ2 велись с учетом отношения количества TGFβ2-показателей к количеству белка. Соответствующие расчеты были проведены и для материала, полученного в ходе биопсии из зоны с патологией, для сравнения с зоной без патологии.
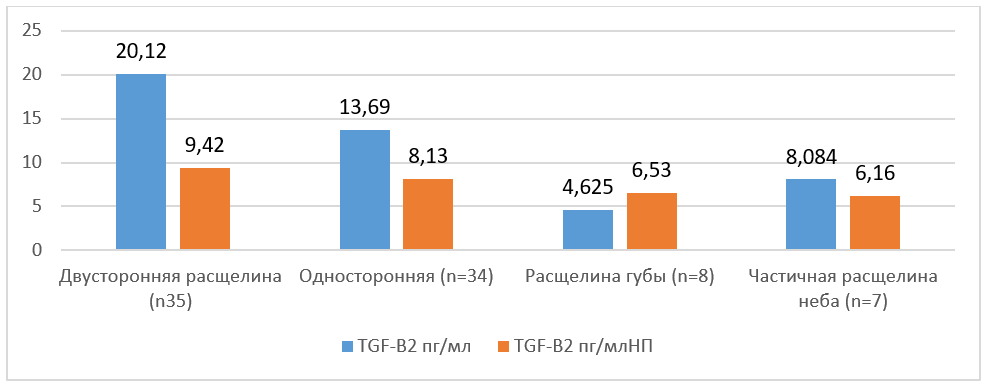
Таблица №4. Значения медианы содержания TGF2 в зоне патологии при различных типах РГН
Показатели TGFβ2 из зоны расщелины имеют значения от 0,10 до 133,97 пг/мл, где среднее значение равно 9,54 пг/мл, 75 % значений меньше или равно 20,57 пг/мл, 25 % равно или ниже 5,58 пг/мл.
Значения TGFβ2 из зоны без патологии составляют от 0,06 до 54,78 пг/мл, где среднее значение равно 6,25 пг/мл, 75 % значений меньше или равно 11,11 пг/мл, 25 % равно или ниже 4,24 пг/мл (Таблица №4).
Таким образом, по результатам иммуноферментного анализа TGFβ22 в мягких тканях при различных типах РГН мы сделали следующие выводы:
- Экспрессия TGFβ2 достоверно повышалась при всех типах РГН, кроме частичной расщелины неба, в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии.
- Наибольшей экспрессия TGFβ2 была при двусторонней расщелине губы и неба, наименьшей — при частичной расщелине неба. Напротив, уменьшение экспрессии TGFβ2 наблюдалось при частичной расщелине губы.
Выводы
- Экспрессия ММП2 повышалась при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии. Наибольшей экспрессия ММП2 была при двусторонней расщелине губы и неба, наименьшей — при расщелине губы, при которой показатели ММП2 в мягких тканях в зоне патологии лишь незначительно увеличивались. Максимальное значение медианы ММП2 в мягких тканях из зоны расщелины составляло 3,578 нг/мл против 2,401 нг/мл из мягких тканей, полученных из зоны без патологии.
- Уровни ММП3 увеличивалась при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии. Наибольшей экспрессия ММП3 была при двусторонней расщелине губы и неба, наименьшей — при расщелине губы, при которой показатели ММП3 в мягких тканях в зоне патологии лишь незначительно увеличивались. Показатель медианы ММП3 из мягких тканей в области расщелины составляет 1,45 нг/мл против 0,72 нг/мл в мягких тканях, полученных из зоны вне очага патологии.
- Показатели ТИМП2 достоверно повышались при всех типах РГН в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии. Наибольшей экспрессия ТИМП2 была при двусторонней расщелине губы и неба, наименьшей — при расщелине губы. Показатель медианы ТИМП2 из мягких тканей в области расщелины составляет 3,29 нг/мл против 1,38 нг/мл в мягких тканях, полученных из зоны вне очага патологии.
- Экспрессия TGFβ2 возрастала при всех типах РГН, кроме скрытой расщелины неба, в мягких тканях, взятых из зоны патологии, по сравнению с мягкими тканями, взятыми из зоны вне очага патологии. Наибольшей экспрессия TGFβ2 была при двусторонней расщелине губы и неба, наименьшей — при частичной расщелине неба. Напротив, уменьшение экспрессии TGFβ2 наблюдалось при частичной расщелине губы. Показатель медианы TGFβ2 из мягких тканей в области расщелины составляет 9,54 пг/мл против 6,25 пг/мл в мягких тканях, полученных из зоны вне очага патологии.
- Установлена достоверная корреляция между показателями ММП2, ММП3, ТИМП2, TGFβ2 в мягких тканях, полученных из зоны патологии, и мягких тканях, полученных из очага вне патологии (р<0,001).
У пациентов с расщелиной губы и неба не было установлено достоверной корреляционной связи между ММП2, ММП3, ТИМП2, TGFβ2 в пределах одного образца. Установлена наибольшая экспрессия ММП2, ММП3, ТИМП2, TGFβ2 в мягких тканях при двусторонней расщелине губы и неба. Наименьшие же значения были получены при расщелине губы. Значения в очаге патологии незначительно (ММП2 и ММП3 менее 10 %, увеличение же при двусторонней расщелине — более 90 %, TGFβ2, напротив, уменьшился на величину более 25 %, а ТИМП увеличился на более 30 %) увеличивались по сравнению с очагом патологии. - В связи с данными ММП2, ММП3, ТИМП2 и TGFβ2 из мягких тканей, полученных из области расщелины губы и неба, а также из очага вне патологии, мы получили достоверное повышение данных биохимических показателей, что свидетельствует о происходящих в этих тканях патологических процессах. Наблюдается нарушение ремоделирования тканей, апоптоза, что с течением времени пагубно сказывается на заживлении после оперативного вмешательства и повышенном образовании рубцов. Рекомендовано проводить первичную хейлопластику при двусторонней и односторонней расщелине губы в периоде новорожденности, для того чтобы снизить вероятность дальнейших осложнений.
- Лавриков В. Г. Особенности логопедической помощи детям с врожденными расщелинами верхней губы и неба на ранних этапах развития / В. Г. Лавриков, Т. Г. Мишина, О. А. Гаврилова // Врожденная и наследственная патология головы, лица и шеи у детей: материалы науч.-практ. конф. — М., 2006. — С. 109—109.
- Митропанова М. Н. Состояние иммунитета у детей с врожденными пороками лица / М. Н. Митропанова, Р. А. Ханферян, В. И. Шульженко // Врожденная и наследственная патология головы, лица и шеи у детей: материалы науч.-практ. конф. — М., 2006. — С. 122—124.
- Потеряева О. Н. Матриксные металлопротеиназы: строение, регуляция, роль в развитии патологических состояний (обзор литературы) // Медицина и образование в Сибири. — 2010. — № 5. — С. 7—17.
- Юлдашев И. М., Танылиев У. А., Керимкулов З. А., Юлдашева Д. Т. Частота рождения детей с врожденной патологией верхней губы и неба на севере Кыргызской Республики // Врожденная и наследственная патология головы, лица и шеи у детей: актуальные вопросы комплексного лечения. — М.: МГМСУ, 2009. — С. 356—357.
- Atkinson J. J, Holmbeck K, Yamada S, et al. Membrane-type 1 matrix metalloprotienase is required for normal alveolar development / Dev Dyn. 2005 Apr; 232(4): 1079—90.
- Baliver L, Lazaryev A, Groffen J, Heisterkamp N, Decler Y, Kaartinen V. 2001. TGFβ3-inducted palatogenesis requires matrix metalloproteinases. Mol Biol 12: 1457—1466.
- Blaha K, Borsky J, Kasparova M et al. Concentrations of MMP-9 and TIMP-1 in lip tissue and their impact on cleft lip surgery healing. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2013; 157(4):363—6.
- Brown N. L, Yarram SJ, Mansell JP, Sandy JR. Matrix metalloproteinases have a role in palatogenesis. J Dent Res 2002; 81:826—30.
- Gawronska-Kozak B. Scarless skin wound healing in FOXN1 deficient (nude) mice is associated with distinctive matrix metalloproteinase expression. Matrix Biol 2011;30(4):290—300.
- Nikopensius T, Kempa I, Ambrozaitytė L et al. Variation in FGF1, FOXE1, and TIMP2 genes is associated with nonsyndromic cleft lip with or without cleft palate. Birth Defects Res A Clin Mol Teratol. 2011;91(4):218—25.
- Ramnath N. Matrix metalloproteinases inhibitors. / Ramnath, N., Creaven, P. J. // Cuur Oncol. — 2004. — № 6. — P. 96—102.
- Westermarck J. Regulation of matrix metalloproteinase expression in tumor invasion. / Westermarck J., Kähäri V. M. // FASEB J. — 1999. Vol. 13, № 8. P. 781—792.