Фотоактивируемая дезинфекция — революционная технология в эндодонтическом лечении
Быстрое развитие лазерных технологий явилось причиной появления новых методик с широкими возможностями, которые нашли применение в различных областях медицины. Революционной на сегодняшний день является технология, имеющая несколько названий: фотоактивируемая дезинфекция (ФАД), бактериотоксическая терапия (БТС-терапия), фотодинамическая терапия (ФДТ) [1, 2, 3, 29].
Суть этого явления — дезинфекция или стерилизация тканей организма с помощью применения фотосенсибилизирующего компонента и активацией лазерным лучом соответствующей длины волны [15]. ФАД может быть вполне достойной альтернативой антисептикам и антибиотикам при лечении локализованных инфекций. Этот метод показал впечатляющие результаты в онкологии, отоларингологии, дермотовенерологии, гинекологии.
В последние годы одновременно в нескольких странах фотоактивируемую дезинфекцию стали практиковать в стоматологии при лечении кариеса и его осложнений, в пародонтологии, имплантологии, при патологиях слизистой оболочки полости рта, в челюстно-лицевой хирургии.
В нашей клинике мы применяем этот метод с 2002 года. Были проведены исследования in vitro и in vivo. Отдаленные результаты — более тысячи клинических наблюдений — позволяют утверждать, что ФАД является ценным компонентом современной лазерной стоматологии.
Актуальность
Эндодонтическое лечение в современной стоматологии становится все более важным. Пациенты ожидают от стоматологов, что результаты лечения будут носить долговременный характер без последующих осложнений. Большинство эндодонтически пролеченных зубов в дальнейшем нуждаются в ортопедических конструкциях, довольно дорогих, долгосрочность функционирования которых во многом зависит от качества проведенного лечения.
Стандарты эндодонтии неуклонно повышаются благодаря исследованиям и тому интересу, который проявляют практикующие врачи. Однако традиционные приемы, даже выполненные очень тщательно, не всегда приводят к успеху. Неравномерность поперечного сечения корневого канала, его сложная анатомическая морфология приводят к формированию областей, где могут аккумулироваться оставшиеся бактерии, что негативно влияет на результат любого эндодонтического лечения.
В этих случаях чрезвычайно важна способность дезинфицирующих средств проникать в ткани зуба и сохранять в них активность. Некоторые стоматологи относятся к дезинфекции каналов как к рутинной процедуре, являющейся традиционной составляющей протокола лечения, а не как к ключевому условию успешной терапии.
Некоторые стоматологи относятся к дезинфекции каналов как к рутинной процедуре, являющейся традиционной составляющей протокола лечения, а не как к ключевому условию успешной терапии
Выбор антисептического раствора и его использование в настоящее время обычно осуществляют эмпирически. Наиболее часто используемым ирригационным средством является гипохлорид натрия, обладающий выраженной антибактериальной активностью, способностью растворять органические составляющие зуба, обеспечивая санацию недоступного для инструментов предентина. Однако гипохлорид натрия, действуя непродолжительно, не способен глубоко проникать в ткани зуба, что снижает его активность в отношении микроорганизмов, находящихся в дентинных канальцах.
Хлоргексидин является достаточно хорошо исследованным препаратом. Известно, что он обладает антибактериальными свойствами именно против микроорганизмов, которых обычно выделяют из корневого канала. И, несмотря на это, в настоящее время в стоматологии отсутствует способ, позволяющий эффективно проводить дезинфекцию корневых каналов.
Лазерные технологии открывают новое перспективное направление в лечении кариеса и его осложнений. Антибактериальное воздействие лазера является важным аспектом его многофакторного влияния на биологические системы. Данный эффект лазерного излучения в комплексе с его уникальными биостимулирующими свойствами может быть использован для селективного подавления патогенной микрофлоры, сенсибилизированной препаратами, активируемыми лазерным светом относительно небольшой мощности.
Метод лечения, основанный на таком эффекте, получил название фотоактивируемой дезинфекции (ФАД), или бактериотоксической светотерапии (БТС-терапии). Принцип его работы основан на том, что молекулы фотосенсибилизатора прикрепляются к мембране грибковых и вирусных клеток. Облучение светом с определенной длиной волны, соответствующей пику поглощения фотосенсибилизатора, приводит к образованию атомарного (синглетного) кислорода, который разрушает их стенки, приводя к их гибели.
Тот факт, что летальная фотосенсибилизация не является видоспецифичной, имеет определенное преимущество, т. е. позволяет уничтожать все имеющиеся микроорганизмы в смешанной инфекции. Важным аспектом этой системы является то, что два ее компонента — фотосенсибилизатор и лазер — при использовании по отдельности не оказывают воздействия на бактерии.
Фотосенсибилизаторы
В естественных условиях только ограниченное число бактерий (род Porphyromonas и Prevotella) способно продуцировать эндогенные вещества, восприимчивые к воздействию света (например, порфирины), и поэтому они могут быть уничтожены с помощью воздействия лазерного луча с соответствующей длиной волны. В противоположность им, для уничтожения всех остальных бактерий, а также грибов и вирусов с помощью ФАД необходимо окрасить красителем их внешние мембраны. Важно, что фотосенсибилизаторы обладают положительным зарядом. Это усиливает их связывание со стенками отрицательно заряженных клеток бактерий.
Типичные микробы, поддающиеся уничтожению с помощью фотоактивируемой дезинфекции:
- Streptococcus sanguis
- Streptococcus mutants
- Streptococcus sabrinus
- Fusobacterium nucleatum
- Actinobacillus actinomycetemcomitans
- Actinomyces viscosus
- Lactobacillus casei
- Lactobacillus fermentum
- Porphyromonas gingivalis
- Salmonella enteritidis
- Staphylococcus aureus
- Candida albicans
- Klebsiella pneumonia
- Pseudomonas aeruginosa
- Escherichia coli
- Enterococcus feacalis
Существует множество видов фотосенсибилизаторов, которые наиболее широко используются в стоматологической практике и оказываются эффективными в борьбе с целым рядом грамположительных и грамотрицательных бактерий [15], включая многие ключевые патогены ротовой полости, такие как Streptococcus mutants и Enterococcus faecalis:
- Хлорид толониума (толуидиновый синий).
- Метиленовый синий.
- Радохлорин (ООО «РАДА-ФАРМА», Россия, патент РФ № 2183956).
- Фотолон (ОАО «БЕЛМЕДПРЕПАРАТЫ», рег. № ПN015948/01, Республика Беларусь).
- Фотодитазин (Россия. Рег. удост. № ФС 012а 2006/4192-06) и др.
Для того чтобы получить оптимальные результаты при использовании ФАД, нужно учесть следующие характеристики фотосенсибилизатора:
- тип клеток для связывания фотосенсибилизатора;
- концентрации, при которых он наиболее эффективен;
- длина волны и интенсивность лазерного луча, требуемые для его активации;
- концентрация, при которой он проявит предполагаемый токсический эффект;
- его растворяемость в воде и окружающих липидах;
- степень ионизации.
Основным свойством фотосенсибилизаторов является их способность поглощения лазерного луча в видимом невооруженным глазом красном спектре. Наиболее распространенные комбинации фотосенсибилизатор/лазер следующие:
- хлорид толониума с полупроводниковым лазером (длина волны: 635 nm);
- радохлорин, фотолон, метиленовый синий, фотодитазин с полупроводниковым лазером (длина волны: 660—670 nm).
Помимо фотосенсибилизирующего красителя, растворы могут включать в себя буферы, соли, регулирующие концентрацию раствора, антиоксиданты, консерванты и поверхностно-активные вещества для обеспечения поверхностного увлажнения. Буферы играют важную роль для достижения достоверного результата при использовании светоактивируемой терапии в клинических условиях. Установлено, что рН среды влияет на свойства и поведение как фотосенсибилизаторов, так и бактерий [21, 40, 41], изменяя проникновение и связывание красителя.
Щелочная среда (рН 8.0) имеет тенденцию создания фотосенсибилизации, противостоящей кислой (рН 4.0 и 5.0), по следующим причинам:
- лучшее проникновение красителя в клетки [42];
- повышенная цитотоксичность молекул синглетного кислорода [40].
Для применения метода светоактивируемой терапии в клинических условиях необходимо поместить фотосенсибилизатор на короткий период времени, 30 секунд, на область воздействия, с тем чтобы микробы смогли поглотить необходимое количество фотосенсибилизатора и стать восприимчивыми к лазерному излучению. Фотосенсибилизатор способен эффективно уничтожить нужную мишень только в том случае, если он активирован светом лазера с соответствующей длиной волны.
Многочисленные исследования, проведенные на целом ряде лабораторных моделей, включая срезы дентина, подтвердили, что воздействие обработки методом фотоактивируемой дезинфекции на микробов, обычно имеющихся в ротовой полости и вызывающих воспаления пародонта, кариес и его осложнения и другие стоматологические заболевания, действительно приводит к их эффективному уничтожению [1—39].
Что касается термического эффекта, то прямые измерения температуры корневой поверхности во время эндодонтической дезинфекции показали, что изменения температуры были ниже 0,5 ºС, а прилегающие ткани не повреждены термическими или химическими ожогами [30, 34, 36].
Применение лазера
В фотоактивируемой дезинфекции обычно используются типы лазеров, действующие в видимом красном диапазоне электромагнитного спектра. К ним относятся полупроводниковые лазеры на алюминий — арсениде галлия (длина волны λ = 633—635 nm или λ = 660—670 nm) и твердотелые лазеры (длина волны λ = 532 nm, зеленый свет). Для эффективного уничтожения микробов с помощью фотоактивируемой дезинфекции с применением лазера его выходные параметры должны составлять порядка 25 J/cm2 — до 200 mW [15]. Время воздействия — от 60 до 120 секунд.
Алгоритм эндодонтического лечения с использованием фотоактивируемой дезинфекции
После открытия системы корневого канала, экстирпации пульпы или ее остатков, избегая проталкивания инфицированных тканей за апикальное сужение, определяют точную рабочую длину с помощью К-файлов № 8—15, которые подбираются в зависимости от величины канала и степени сужения. Для локализации апикального отверстия используется метод апекслокации с дополнительным рентгеновским контролем.
Определение апикальной границы фиксируется с помощью ограничителя, установленного на К-файле. Далее используется техника crown down для прохождения и расширения канала Niti-инструментами размера № 30 по ISO с конусностью 0,6 и 0,4. При каждой смене инструмента каналы промываются 3%-ным раствором гипохлорида натрия.
Расширение канала заканчивается использованием последнего файла размером № 40 и конусностью 0,4 по ISO. После завершения механической подготовки канала производится обработка 17%-ным раствором ЭДТА для удаления смазанного слоя и открытия дентинных канальцев. В завершение канал тщательно промывается дистиллированной водой для удаления применявшихся ранее растворов с высушиванием стерильными бумажными штифтами.
Воздействие ФАД на микробы, обычно имеющиеся в ротовой полости и вызывающие различные стоматологические заболевания, действительно приводит к их эффективному уничтожению
Для проведения ФАД после завершения механической обработки и ирригации в корневой канал с помощью стерильной эндодонтической иглы на рабочую длину вводится фотосенсибилизирующий раствор, который оставляется в течение фиксированного периода времени, 60 с, для того чтобы он вступил в контакт с бактериями и диффундировал вглубь. Рабочая длина переносится и фиксируется с помощью резинового стопера на лазерный световод. Эндодонтический излучатель вводится в канал не доходя до апекса на 4 мм. Далее активируется лазер при мощности 100—200 мВт в течение 120 с.
Во время активации излучателем совершаются спиралеобразные движения вверх и вниз на 3 мм с 20-секундными интервалами. Завершается лечение полным пломбированием канала гуттаперчей с использованием метода латеральной конденсации.
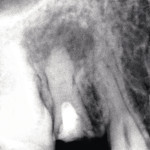
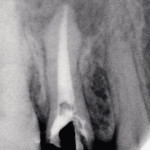
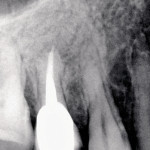
В случае наличия свищевого хода при гранулематозном периодонтите после завершения механической очистки с последующей ирригацией его 3%-ным раствором гипохлорида и 17%-ным раствором ЭДТА фотосенсибилизатор вносится как внутриканально, так и по свищевому ходу до упора. Через 60 с экспонирования лазерный световод для эндодонтического лечения вводится в подготовленный канал и устанавливается у апикального сужения. После чего обрабатываются боковые стенки канала и латеральные канальцы. Далее используется универсальный световод, направляемый на проекцию апикальной области. Завершается лечение пломбированием канала с дальнейшим изготовлением ортопедической конструкции (рис. 1—3).
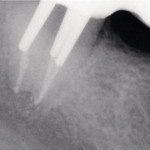
- Рис. 1. Рентгеновский снимок 15 зуба до лечения.
- Рис. 2. Рентгеновский контрольный снимок после пломбирования 15 зуба.
- Рис. 3. Рентгеновский снимок 15 зуба через два года после лечения.
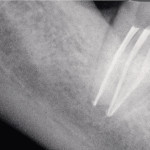
После проведения курса ФАД каналов корней зуба пациентов с периодонтитом обострение, которое бы вызывало беспокойство больных в течение первых 3—5 дней, наблюдалось только в 3 % случаев. У пациентов с гранулематозным периодонтитом в первые 2—3 дня исчезали свищевые ходы и другие признаки воспаления. В отдаленные сроки наблюдения обострение хронического периодонтита отсутствовало, клиническое благополучие отмечено у всех пациентов (рис. 4, 5).
- Рис. 4. Рентгеновский снимок 47 зуба через 6 месяцев после ФАД.
- Рис. 5. Рентгеновский снимок 47 зуба через два года после ФАД.
При рентгенологическом обследовании состояния периапикальных тканей через 6 месяцев, 1 и 2 года после ФАД каналов корней зубов при хроническом гранулирующем периодонтите полная регенерация отмечена в 51,9 % случаев, частичная — в 36,1 %, ткани остались без изменений в 15,8 % случаев.
Эффективность ФАД зависит от четкого соблюдения алгоритмов лечения и параметров лазерного излучения
При гранулематозном периодонтите полное восстановление тканей в периапикальной области наблюдалось в 47,8 %, частичное — в 39,1 %, ткани остались без изменений в 13,1 % случаев. Увеличения очага деструкции не наблюдалось. Следовательно, ФАД при консервативном лечении деструктивных форм хронического периодонтита способствует повышению эффективности лечения, а также регенерации костных структур в околоверхушечной области.
ФАД корневых каналов обеспечивает полную санацию во всех без исключения случаях, происходит полная элиминация микрофлоры из корневых каналов. Рефрактерных к стерилизации микроорганизмов не отмечено. Данный метод сочетает в себе управляемое бактериотоксическое воздействие активированного лазером фотосенсибилизатора на очаг воспаления и биостимулирующее действие и повышает эффективность эндодонтического лечения.
Эффективность фотодинамической дезинфекции зависит от четкого соблюдения алгоритмов лечения и параметров лазерного излучения. В этом случае достигается желаемый клинический результат. Фотоактивируемая дезинфекция является высокоэффективным, малоинвазивным, имеющим минимум противопоказаний, экологически чистым, экономически приемлемым методом лечения воспалительных заболеваний полости рта и улучшит качество жизни наших пациентов.
ЛИТЕРАТУРА
1. Рисованная О. Н. Экспериментально-клиническое обоснование бактериотоксической светотерапии воспалительных заболеваний тканей пародонта // Диссертация на соискание ученой степени доктора медицинских наук. — 2005. — С. 324.
5. Рисованная О. Н. Изучение влияния бактериотоксической терапии в эксперименте // Российский стоматологический журнал. — Москва, 2004. — № 4. — С. 7—8.
Полный список литературы находится в редакции.