Коррекция микробного дисбаланса при хронических заболеваниях СОР
И. В. Анисимова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Росздрава
М. О. Нагаева
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Росздрава
М. Г. Чеснокова
д. м. н., профессор, кафедра микробиологии, вирусологии и иммунологии ГОУ ВПО ОмГМА Росздрава
Известно, что большинство хронических воспалительных поражений слизистой оболочки рта провоцируются или осложняются условно патогенной микрофлорой ротовой полости [6]. Снижение активности местных факторов резистентности полости рта приводит к нарушению равновесия в составе резидентной микрофлоры, в результате чего развивается дисбактериоз, ведущий к прогрессированию хронического воспаления, утяжелению течения и снижению эффективности лечения [1, 4].
Актуальность исследования
Использование антимикробных препаратов при лечении заболеваний СОР может влиять на все звенья микробиоценоза и на состав представителей постоянной резидентной микрофлоры [2]. Поэтому в комплексном лечении болезней СОР необходимо наряду с антисептиками дополнительно использовать препараты, направленные на восстановление резидентной нормальной микрофлоры полости рта [1, 5].
Цель исследования
Исходя из вышеизложенного, целью нашего исследования явилось определение характера микробного биоценоза полости рта при различных хронических заболеваниях СОР и клинико-микробиологическое обоснование коррекции дисбиоза с учетом определения чувствительности выделенных из полости рта культур к химиотерапевтическим препаратам и бактериофагам.
Материалы и методы. На базе ГКСП № 1 г. Омска нами проведено обследование 43 человек в возрасте от 35 до 72 лет с жалобами на боль, дискомфорт, жжение в слизистой оболочке различных отделов полости рта. Клиническое обследование пациентов осуществлялось с учетом алгоритма, предложенного Недосеко В. Б., Анисимовой И. В. [3], включало основные методы, ОКАК, анализ крови на сахар, биопотенциалометрию и цитологическое исследование (по показаниям). Кроме того, у всех пациентов проводилось микробиологическое исследование материала, полученного путем соскоба со слизистой оболочки рта в зоне элементов поражения. Забор материала осуществляли до начала лечебных мероприятий. Пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур.
Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию при кафедре микробиологии, вирусологии и иммунологии ГОУ ВПО «ОмГМА» Росздрава.
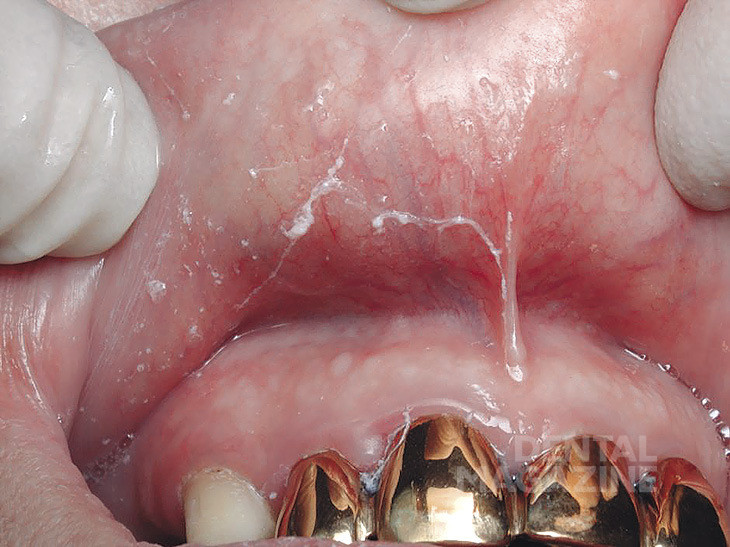
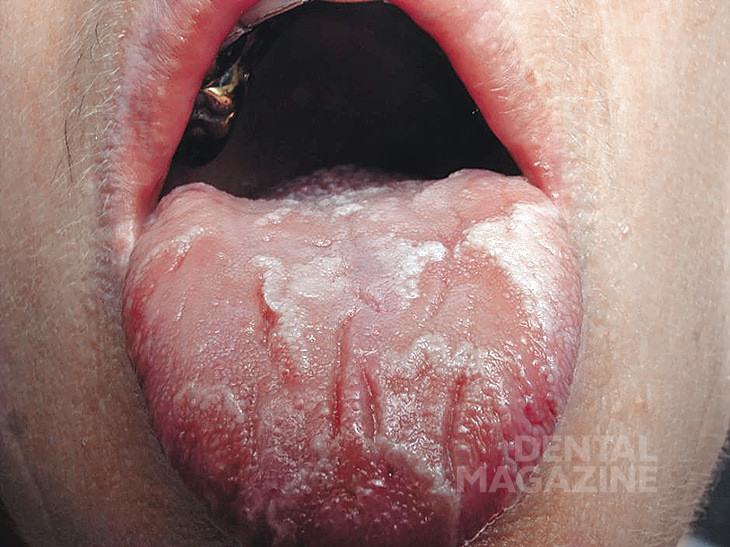
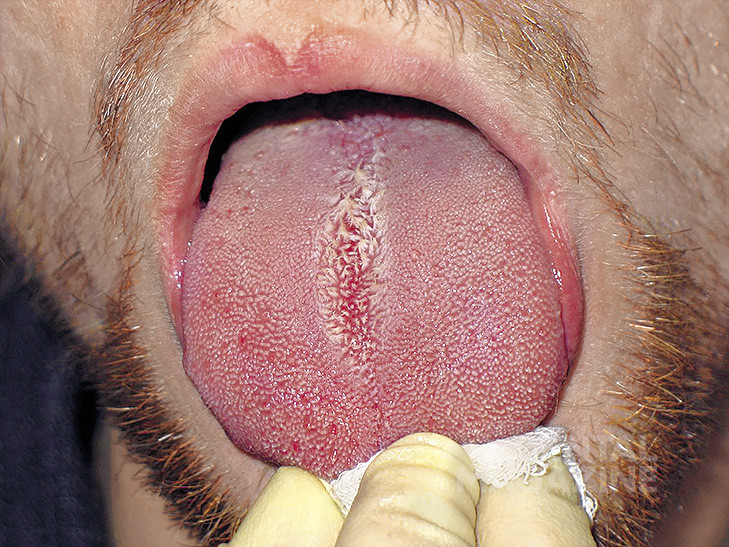
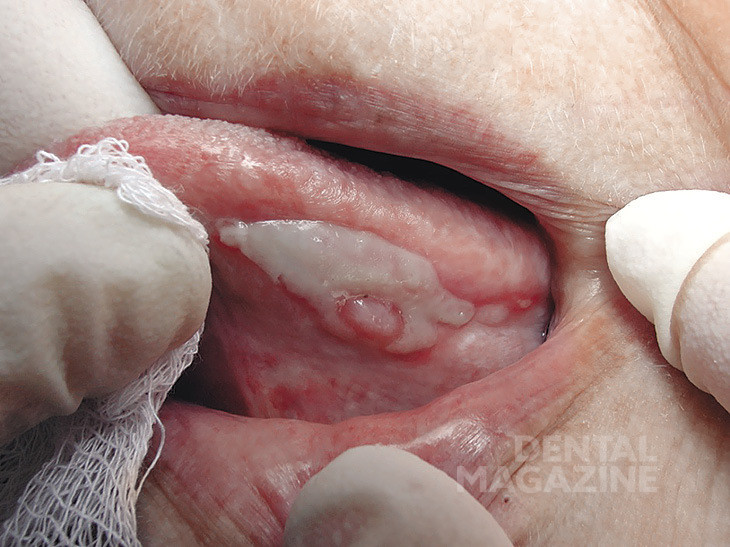
В ходе клинического обследования пациентов (43человека) нами выявлены следующие формы заболеваний слизистой оболочки рта: красный плоский лишай (экссудативно-гиперемическая и эрозивно-язвенная формы) у 21 человека (рис.1), лейкоплакия (плоская и бляшечная формы) у 7 человек (рис. 2), гальваноз полости рта у 8 человек (рис. 3), десквамативный и ромбический глоссит у 5 человек (рис. 4, 5), хроническая механическая травма у 2 человек (рис. 6).
У всех обследуемых пациентов обнаружена сопутствующая патология. Наиболее часто встречались следующие состояния: заболевания органов желудочно-кишечного тракта, артериальная гипертензия, сахарный диабет и другая эндокринная патология.
Все обследованные пациенты получали комплексное лечение, которое было индивидуализированным, этиопатогенетическим или симптоматическим, последовательным, согласно диагностируемой нозологической форме. Кроме того, каждому пациенту с нарушением микробного биоценоза назначались химиотерапевтические препараты и бактериофаги по чувствительности микробных культур исходя из индивидуального микробиологического исследования материала из полости рта.
Результаты исследования и обсуждение
В результате микробиологического исследования материала из полости рта 43 пациентов выделено и идентифицировано 67 штаммов условно патогенных микроорганизмов (табл. № 1).
Таблица № 1. Количественный и качественный состав микрофлоры полости рта у пациентов с заболеваниями СОР
| Выделенный вид микроорганизмов |
Концентрация выделенных микроорганизмов (КОЕ) | |||||||||
| 102 КОЕ | 104 КОЕ | 106 КОЕ | 108 КОЕ | 1010 КОЕ | ||||||
| абс. | отн. | абс. | отн. | абс. | отн. | абс. | отн. | абс. | отн. | |
| Candida albicans | 3 | 4,5 | 5 | 7,5 | 5 | 7,5 | 7 | #### | — | — |
| A.haemoliticus | — | — | — | — | — | — | 1 | 1,5 | — | — |
| A.calcoceticus | — | — | — | — | 1 | 1,5 | — | — | — | — |
| Esherichia coli | — | — | 1 | 1,5 | 1 | 1,5 | 1 | 1,5 | — | — |
| Enterococcus faecalis | — | — | — | — | 1 | 1,5 | 2 | 3 | — | — |
| Enterococcus faecium | — | — | — | — | 4 | 6 | — | — | — | — |
| Staphylococcus aureus | — | — | — | — | 1 | 1,5 | — | — | — | — |
| Streptococcus viridans | — | — | 1 | 1,5 | 2 | 3 | 1 | 1,5 | 1 | 1,5 |
| Maraxella lacunata | — | — | — | — | 2 | 3 | — | — | — | — |
| Maraxella catarhalis | 1 | 1,5 | 1 | 1,5 | 1 | 1,5 | — | — | — | — |
| Micrococcus | — | — | — | — | 1 | 1,5 | — | — | — | — |
| Streptococcus sanguis | — | — | — | — | 2 | 3 | 1 | 1,5 | — | — |
| Streptococcus saliyarius | — | — | 1 | 1,5 | 3 | 4,5 | — | — | — | — |
| Staphylococcus epidermidis | — | — | 3 | 4,5 | 3 | 4,5 | — | — | — | — |
| Streptococcus agalactiae | — | — | — | — | 1 | 1,5 | — | — | — | — |
| Enterobacter agglomerans | — | — | 1 | 1,5 | — | — | — | — | — | — |
| Haemophilis influenzae | — | — | 1 | 1,5 | 3 | 4,5 | 1 | 1,5 | — | — |
| Streptococcus гр. B | — | — | 1 | 1,5 | — | — | — | — | — | — |
| Citrobacter freundii | — | — | — | — | — | — | 1 | 1,5 | — | — |
| Streptococcus pyogenes | 1 | 1,5 | — | — | — | — | — | — | — | — |
| Всего: | 5 | 7,5 | 15 | 22,5 | 31 | 46 | 15 | 22,5 | 1 | 1,5 |
Большинство выделенных микроорганизмов высевалось в значимых концентрациях (104 КОЕ — 22,5 %, 106 КОЕ — 46 %, 108 КОЕ — 22,5 %). Монокультура условно патогенных микроорганизмов выявлялась у 21 % (14) человек. При этом в монокультуре определялись следующие представители Гр «+» кокков: S. salivarius, S. viridans, S. sanguis, S aureus, S. pyogenus, E. faecalis, E. faecium, Micrococcus; Гр «-» кокков: M. lacunata H. Influenzae; Гр «-» энтеробактерий: C. freundi, E. coli.
При анализе сформировавшихся ассоциаций микроорганизмов установлено, что у 64 % больных выявлены двухкомпонентные микробные ассоциации, большая часть из которых (74 %) — с участием грибов рода Candida в различных концентрациях (с преобладанием в концентрации 108 КОЕ — 33,3 %). При этом Candida albicans в концентрации 102 КОЕ встречалась в ассоциации с S. viridans (106 КОЕ) и H. Influenzae (108 КОЕ); в концентрации 104 КОЕ — в ассоциации с S. epidermidis (106 КОЕ), S. sanguis (108 КОЕ), S agalactia (106 КОЕ); в концентрации 106 КОЕ — в ассоциации с E. agglomerans (104 КОЕ), Streptococcus группы B (104 КОЕ), M. сatarhalis (104 КОЕ); в концентрации 108 КОЕ с M. lacunata (106 КОЕ), S. salivarius ( 106 КОЕ), S. viridans (106 КОЕ) и E. faecium (106 КОЕ).
Снижение количества нормофлоры регистрировалось у всех обследуемых пациентов, при этом лактобактерии в концентрации менее чем 104 КОЕ определялись у 29 человек (69 %), снижение концентрации бифидобактерий менее 104 КОЕ — у 34 человек (81 %). Полная эрадикация лактобактерий и бифидобактерий наблюдалась у 4 пациентов (9,5 %).
У 100 % обследованных больных выявлены изменения микробиоценоза, характерные для дисбактериоза полости рта различной степени тяжести. Структура этих изменений в соответствии с классификацией дисбактериоза ротоглотки, предложенной Хазановой В. В. с соавт. (1996), представлена на рисунке 7.
Наиболее выраженные изменения микробиоценоза, соответствующие дисбактериозу IV степени, определялись у пациентов с явлениями гальваноза полости рта. В ходе определения чувствительности выделенных микроорганизмов к антибактериальным препаратам выявлено 60 (89,5 %) штаммов микроорганизмов с признаками антибиотикорезистентности. Формирование антибиотикоустойчивости свидетельствует об усилении патогенных свойств микроорганизмов.
В плане выбора антимикотических препаратов, у 13 штаммов Candida albicans (62 %) отмечалась устойчивость к нистатину. В ряде случаев определялась устойчивость штаммов Candida albicans к амфотерицину В и клотримазолу. Все выявленные штаммы Candida albicans были чувствительны к флуконазолу, кетоконазолу, интраконазолу. Определение чувствительности выделенных микроорганизмов к бактериофагам показало, что у большинства пациентов была выражена чувствительность к бактериофагу пио, поливалентному бактериофагу (секстафагу), бактериофагу интести. Исходя из этих данных, мы проводили коррекцию микробного дисбаланса полости рта у пациентов с хроническими заболеваниями СОР, соблюдая последовательность этапов лечения [1, 7].
Принцип последовательности заключается в удалении из полости рта патогенных и условно патогенных микроорганизмов — деконтаминации с целью создания благоприятных физиологических условий для заселения и размножения нормальной микрофлоры.
Этап деконтаминации у обследуемых пациентов мы проводили путем назначения комплекса препаратов (антисептики + фунгицидные средства + бактериофаги), согласно выявленной чувствительности штаммов микробов из полости рта каждого индивидуума.
В качестве антисептика мы использовали растворы хлоргексидина биглюконата 0,05%-ные и 0,1%-ный гексетидина в виде полосканий, чередуя, дважды в день после приема пищи по 10—15 мл в течение 30—60 сек. на протяжении 5—7 дней. Антимикотические или фунгицидные препараты назначались системно (флуконазол или итраконазол по 50—100 мг) один раз в день в течение 7—14 дней.
Местно применяли раствор кандида 1%-ный по 10—20 капель путем нанесения на слизистую оболочку полости рта 3—4 раза в день в течение 7—14 дней, кандид — 1%-ную мазь (в виде сэндвич-аппликаций) — 4 раза в день — 14 дней начиная с 5—7-го дня от начала терапии. Бактериофаги (пибактериофаг, секстафаг) назначали в виде ротовых ванночек по 20 мл 2 раза в день за полчаса перед приемом пищи в течение 7—14 дней.
Второй этап контаминации — восстановление физиологического равновесия микрофлоры полости рта и желудочно-кишечного тракта. В качестве лекарственных препаратов с целью восстановления нормальной флоры мы использовали пробиотики. Согласно современному определению, пробиотики — это живые, специально подобранные штаммы микроорганизмов или специфические субстанции микробного, растительного или животного происхождения.
При введении в организм они благоприятно влияют на его эндогенную микрофлору, корригируя ее [1, 7]. Для реализации этой цели мы назначали обследуемым пациентам поликомпонентный пробиотик III поколения ацилакт по 5 доз 2 раза в день 14 дней или сорбированный бифидосодержащий пробиотик IV поколения бифидумбактерин форте (в капсулах) по 5 доз в день 7—14—21 день.
Третий этап терапии — наблюдение в динамике за поражением слизистой оболочки полости рта обследуемых пациентов. Клинический осмотр и отсутствие жалоб у пациентов на третьем этапе лечения показали, что коррекция дисбиотических нарушений у лиц с хроническими заболеваниями СОР повысила эффективность комплексного лечения нозологических форм.
Заключение
Представленные данные позволяют заключить:
- Лица с хроническими заболеваниями СОР в 100 % случаев имели нарушения микробиологического равновесия в полости рта.
- Среди выделенных ассоциаций микроорганизмов преобладали бактериально-грибковые.
- Коррекция микробного дисбаланса путем последовательной деконтаминации и контаминации имела позитивное значение в комплексном лечении хронических заболеваний СОР и достижении длительной ремиссии.
- Боровский Е. В. Кандидоз. / Е. В. Боровский, Л. М. Лукиных // Маэстро стоматологии. — 2011, № 4 (44). — С. 15—18.
- Грудянов А. И. Применение таблетированных форм пробиотиков бифидумбактерина и ацилакта в комплексном лечении воспалительных заболеваний пародонта / А. И. Грудянов, Н. А. Дмитриева, Е. В. Фоменко // Стоматология. — 2002, № 1. — С. 39—43.
- Недосеко В. Б. Алгоритм обследования больного с заболеваниями слизистой оболочки полости рта и губ / В. Б. Недосеко, И. В. Анисимова // Институт стоматологии. — 2003, № 2 (19). — С. 32—36.
- Хазанова В. В. Изучение микробиоценоза при хронических заболеваниях слизистой оболочки полости рта / В. В. Хазанова, И. М. Рабинович, Е. А. Земская, О. Ф. Рабинович, Н. А. Дмитриева // Стоматология. — 1996. — Т. 75, № 2. — С. 26—28.
- Чепуркова О. А. Обоснование использования антисептических препаратов в комплексном лечении пациентов с ХГП и обсемененностью биотопа пародонтального кармана Candida / О. А. Чепуркова, М. Г. Чеснокова, В. Б. Недосеко // Пародонтология. — 2009, № 2 (51). — С. 34—39.
- Чеснокова М. Г. Клиническая микробиология полости рта: Учебно-методическое пособие / М. Г. Чеснокова, Н. В. Рудаков. — Омск, 2007. — 232 с.
- Шумский А. В. Кандидоз полости рта / А. В. Шумский, В. А. Железняк / Монография. — Самара, 2008. — 199 с., ил.