Новый подход в имплантации пациентов с хроническими заболеваниями. Да или нет — узким имплантатам
И. Мушеев
д. м. н., профессор, член Международной ассоциации врачей-стоматологов
В. Балин
д. м. н., профессор, заведующий кафедрой челюстно-лицевой хирургии и стоматологии ИУВ «НМХЦ им. Пирогова»
Любое медицинское вмешательство обычно имеет свои показания и противопоказания. При дентальной имплантации для пациентов возможно наличие нескольких вариантов: есть показания и нет противопоказаний (идеальный вариант); есть показания и есть противопоказания (лечение возможно); нет показаний и нет противопоказаний (лечение лучше не проводить); нет показаний и есть противопоказания (лечение проводить нельзя).
Но в практике насчет показаний и противопоказаний существует различные мнения. За последние 20 лет мнение о противопоказаниях к имплантации зубов изменилось. Противопоказания бывают местные и общие, временные и постоянные, абсолютные и относительные. И, так как устранение местных и временных противопоказаний является частью назначаемого лечения, наиболее важна для нас классификация абсолютности-относительности противопоказаний. Важно отметить, что с увеличением опыта работы с дентальными имплантатами список абсолютных противопоказаний уменьшился в пользу относительных противопоказаний. Так, к абсолютным противопоказаниям к имплантации зубов относятся заболевания крови и кроветворных органов в стадии декомпенсации, заболевания центральной нервной системы и психические нарушения (как врожденные, так и приобретенные), злокачественные новообразования различных органов и систем в периодах до, во время и через 6—12 месяцев после лечения, а также иммунопатологические заболевания, системные заболевания соединительной ткани, туберкулез и сахарный диабет в стадии декомпенсации. К относительным противопоказаниям к имплантации зубов или факторам риска относятся все общие и местные хронические заболевания в стадии компенсации, которые достаточно хорошо диагностируются и лечатся (компенсация) благодаря использованию в современной медицине уникального оборудования и широкого спектра фармакологических средств. Однако, проанализировав данные литературы, можно утверждать, что проблема предупреждения осложнений у пациентов с хроническими заболеваниями в виде нестабильности дентального имплантата в кости остается весьма актуальной [1]. Изучая собственный опыт работы, научные статьи по применению дентальных имплантатов у больных с хроническими заболеваниями, понимаем, что однозначного подхода не существует [2]. Несмотря на преимущества дентальной имплантации, имеются некоторые сложности в использовании этого метода у пациентов с хроническими заболеваниями. Кроме того, количество и качество костной ткани является важным фактором, который может отразиться на исходе лечения дефектов зубных рядов методом дентальной имплантации [3—5]. Установлено, что с общим снижением костной массы в периимплантационной зоне больных, не страдающих хроническими заболеваниями, уменьшаются темпы физиологической и репаративной регенерации, уменьшается удельный вес непосредственно костных структур и параллельно увеличивается доля губчатого компонента, а также отличается нарастанием примитивной грубоволокнистой кости и хондроидной зоны в имплантационной зоне (абсолютная и относительная остеоатрофия), поздним появлением, но длительной персистенцией сосудисто-соединительнотканной массы (ангиогрануляционной ткани) по периметру и/или на поверхности имплантата, замедлением темпов периимплантатного остеогенеза, частичным, значительным или полным подавлением восстановления кортикальной пластины компактной кости после имплантирования, подавлением перестройки (ремоделирования) костной основы и ее адаптации к новым условиям функционирования. Таким образом, при хронических заболеваниях общеорганизменные заболевания у больных ухудшают совокупность морфогистохимических свойств тканевых комплексов (базиса) в зоне имплантата, что следует рассматривать как негативный, неблагоприятный фактор как при имплантировании, так и при прогнозировании результатов выполненной операции [6, 7]. Представляет интерес изучение возможности использования для больных с хроническими заболеваниями метода имплантации, включая выбор имплантата, позволяющее сохранить максимальное количество костной ткани и репаративные свойства кости в зоне имплантации.
Цель исследования
Найти необходимые диагностические и лечебные мероприятия у пациентов с хроническими заболеваниями для увеличения срока службы имплантатов и протезных конструкций на имплантатах и уменьшения резорбции кости челюстей вокруг установленных имплантатов.
Материалы и методы исследования
Работа выполнена на клиническом материале. За период с 2010 по 2015 г. нами обследовано и проведено лечение 370 пациентов в возрасте от 31 до 94 лет с первичной и вторичной адентией: мужчин — 174 (47,03 %), женщин — 196 (52,97 %). Всего было установлено 1113 титановых имплантатов различных диаметров, из них универсал — 779 (70 %), респект — 204 (18,3 %), классик — 130 (11,7 %). Диаметр установленных имплантатов колебался от 3.0 до 6 мм. Длина имплантатов — от 5 до 18 мм. Установка имплантатов осуществлялась при полном отсутствии зубов на одной челюсти, 32 больным установлено 336 имплантатов (30,2 %), при отсутствии двух и более зубов на одной челюсти, 132 больным установлено 528 имплантатов (47,4 %), при отсутствии или удалении одного зуба на одной челюсти, 206 больным установили 249 имплантатов (22,4 %). Использовались имплантаты, хирургические инструменты, абатменты и протезные детали системы Green Implant Systems GmbH (Германия). Все пациенты, выбранные для проведения исследования, первоначально проходили традиционное обследование: сбор анамнеза; лабораторные исследования; анализ моделей челюстей и определение окклюзионных взаимоотношений челюстей; изучались прицельные внутриротовые снимки (PER), ортопантомограммы (PAR) и компьютерная томография (СТ). С учетом общесоматических хронических заболеваний все пациенты были распределены на 2 основные клинические группы: в первой группе 177 пациентов с различными хроническими заболеваниями в стадии компенсации, во второй группе 193 практически здоровых пациента. Каждая группа имела по шесть подгрупп в зависимости от диаметра устанавливаемого имплантата. В первую группу были включены пациенты с хроническими заболеваниями (с сахарным диабетом, почечной и сердечной недостаточностью, пациенты, принимающие иммунодепрессивные препараты, а также пациенты с заболеванием крови, туберкулезом, гепатитом С, СПИД, псориазом, заболеваниями слизистой оболочки и с хроническим генерализованным пародонтитом) в стадии компенсации.
Предхирургический и хирургический этап во всех группах проводился по общепринятой методике. Имплантация проводилась в одно- или двухфазной методике, также проводилась методика непосредственной имплантации и одномоментной нагрузки на имплантатах. Все имплантаты устанавливались по возможности по методу межкортикальной фиксации. Во всех группах по показаниям проводилась направленная регенерация костной ткани вокруг имплантатов (аугментация кости). Через 3—6 месяцев проводилось восстановление зубных рядов (протезирование на имплантатах) постоянными съемными и несъемными конструкциями. На всех этапах лечения во всех группах проводился мониторинг тканей вокруг имплантатов. Оценку аспектов костноимплантного интерфейса, таких как подвижность имплантата, проверяли и замеряли по состоянию кости вокруг имплантатов, по СТ, PAR и PER-рентгенографии, которые производились до операции, сразу после установки имплантата, перед раскрытием имплантатов, перед и после установки протезной конструкции и во время профилактических осмотров.
Статистические расчеты и обработка данных
Статистические расчеты по всем показателям проводили согласно диаметру установленного дентального имплантата во всех группах. Периоды контрольной оценки: первый — от 1 до 6 месяцев после имплантации перед установкой протезной конструкции; второй — от 36 до 60 месяцев после имплантации.
Статистическая обработка осуществлялась по следующим показателям: 1 — MU, 2 — PI, 3 — CTC, 4 — LOI, 5 — SOI, 6 — SCI.
Полученные цифровые данные были обработаны методами вариационной и альтернативной статистики, предназначенными для малых объемов исследуемых выборок. Для каждого конкретного показателя были вычислены средние арифметические показатели [8].
Результаты исследования
Клинические исследования показали, что послеоперационный период у пациентов проходил с осложнениями и без осложнений в зависимости от общесоматического состояния и диаметра установленного имплантата. В первой группе у 95.4 % пациентов, а во второй группе у 95,9 % операционная рана над имплантатом заживала первичным натяжением.
Из 500 установленных имплантатов на первом этапе у пациентов первой группы (табл. № 1) не прижились 18 (3,6 %) имплантатов.
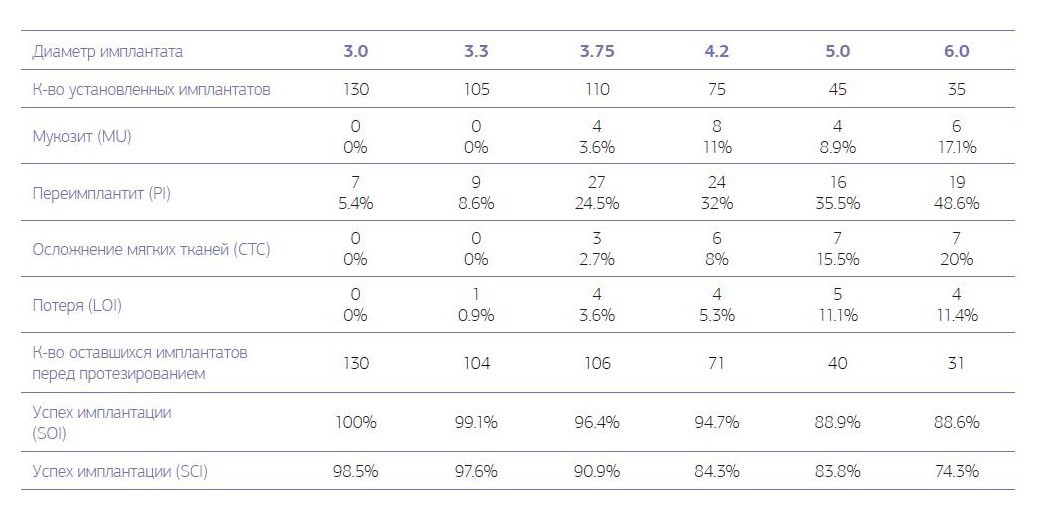
Таблица № 1. Осложнения имплантата для контрольной оценки в 1-й группе на 1-м этапе, от 1 до 6 месяцев после имплантации перед установкой протезной конструкции.
Во второй группе из 613 установленных имплантатов на первом этапе (табл. № 2) не прижились 9 (1,5 %) имплантатов.
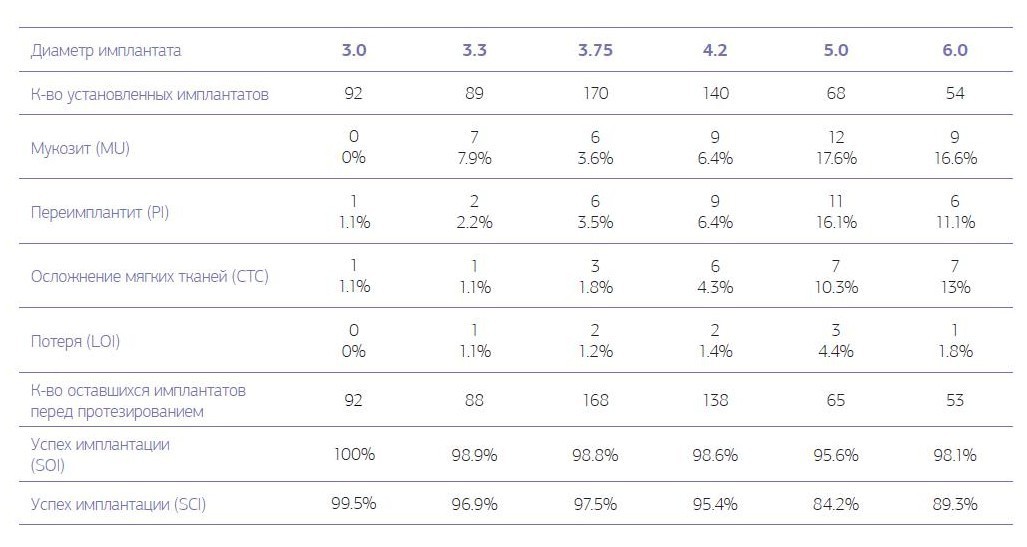
Таблица № 2. Осложнения и долговечность имплантата для контрольной оценки во 2-й группе на 1-м этапе, от 1 до 6 месяцев после имплантации перед установкой протезной конструкции.
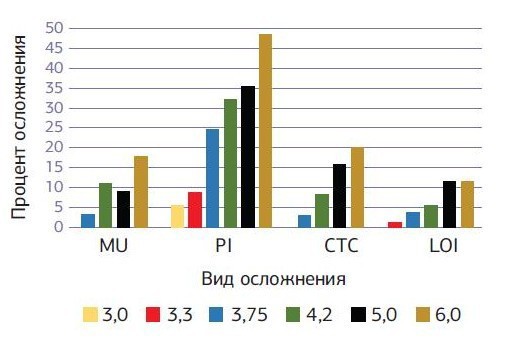
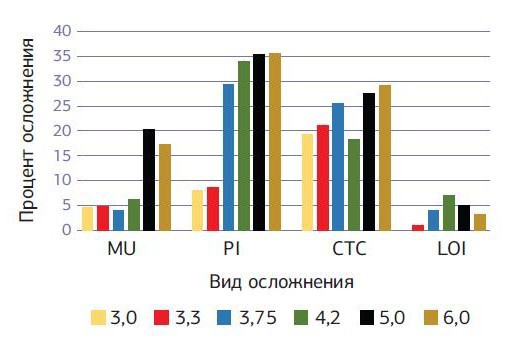
Развитие послеоперационного периимплантита зарегистрировано у 102 (20,4 %) имплантатов пациентов первой группы и у 35 (5,7 %) имплантатов пациентов второй группы. Локальное поражение десенного края (мукозит) без утраты кости вокруг имплантата на первом этапе наблюдалось у 22 (4,4 %) имплантатов пациентов первой группы и 43 (7 %) имплантатов пациентов второй группы. В первой группе успех имплантации на первом этапе, когда любые осложнения отсутствуют, наблюдался у 88,2 % имплантатов, во второй группе — у 93,8 % имплантатов. Наблюдается закономерность того, что с увеличением диаметра устанавливаемого имплантата увеличиваются полученные осложнения вокруг установленного имплантата. При хронических заболеваниях увеличение осложнений с увеличением диаметра имплантата более выраженно по сравнению с практически здоровыми пациентами (диаграммы № 1, 2).
- Диаграмма № 1. Сравнительная диаграмма осложнений вокруг имплантатов через 1—6 месяцев после имплантации в зависимости от диаметра установленного имплантата у пациентов с хроническими заболеваниями.
- Диаграмма № 2. Сравнительная диаграмма осложнений вокруг имплантатов через 1—6 месяцев после имплантации в зависимости от диаметра установленного имплантата у практически здоровых пациентов.
На втором этапе имплантации, после установки постоянной протезной конструкции, из 482 остеоинтегрированных имплантатов у пациентов первой группы (табл. № 3) отторглись или были удалены 13 (2,6 %) имплантатов, а во второй группе из 604 остеоинтегрированных имплантатов на первом этапе (табл. № 4) отторглись или были удалены 12 (2 %) имплантатов.
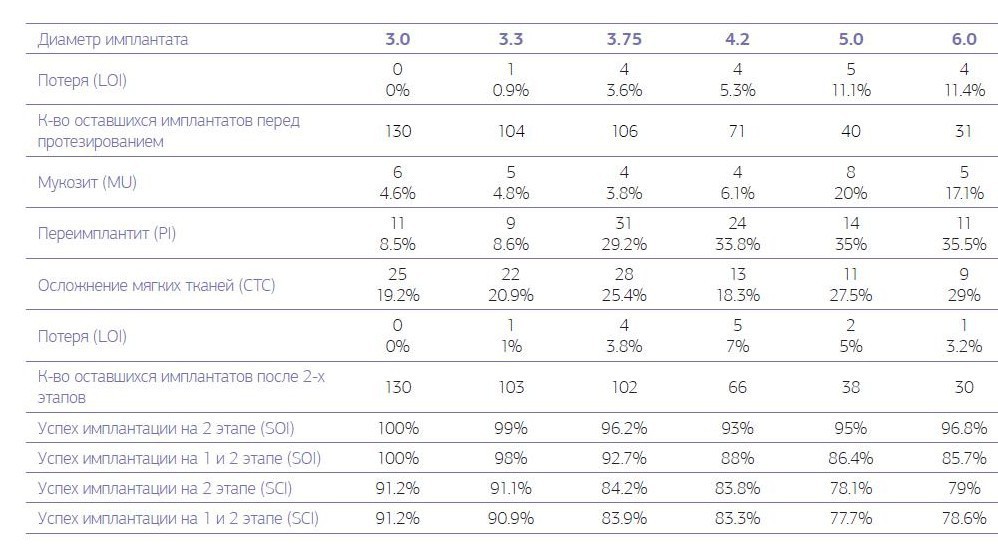
Таблица № 3. Осложнения и долговечность имплантата для контрольной оценки в 1-й группе на 2-м этапе, от 36 до 60 месяцев после имплантации.
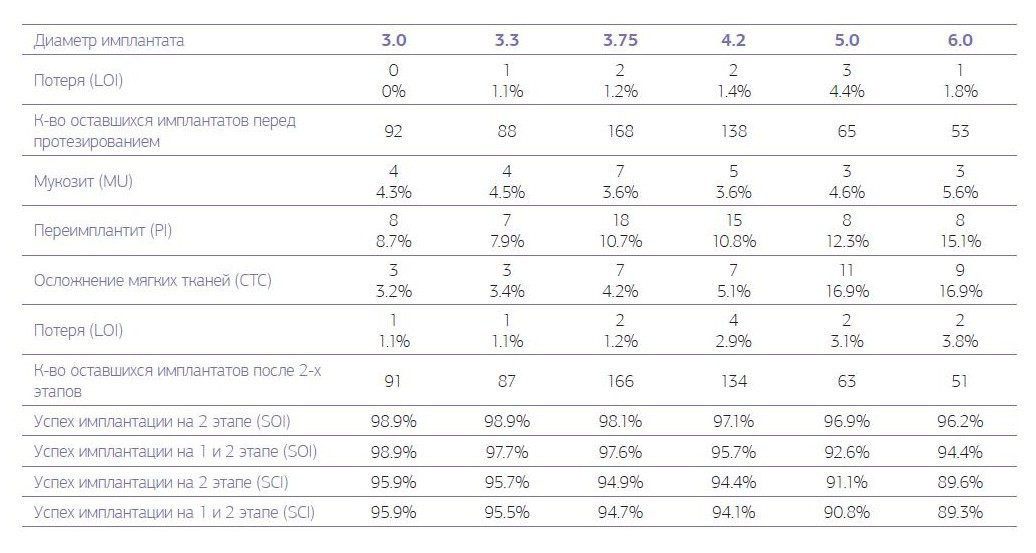
Таблица № 4. Осложнения и долговечность имплантата для контрольной оценки во 2-й группе на 2-м этапе, от 36 до 60 месяцев после имплантации.
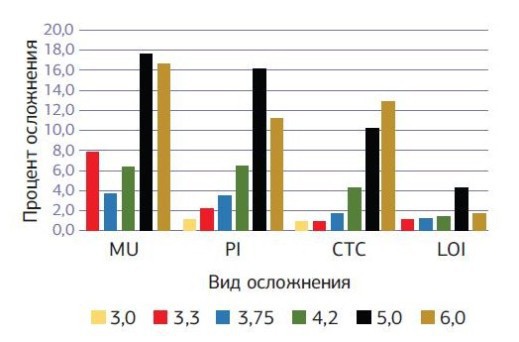
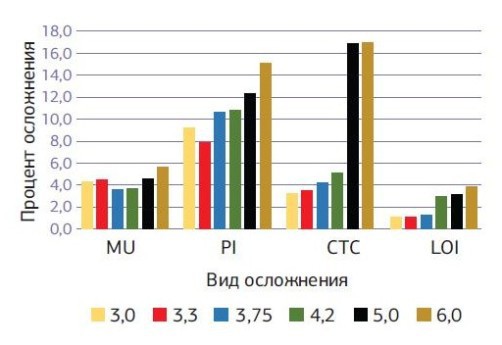
Периимплантит у пациентов первой группы на втором этапе вокруг 100 (20 %) имплантатов сохранил свои показатели по сравнению с первым этапом; аналогичный показатель у пациентов второй группы увеличился почти в 2 раза и составил 64 (10,4 %). Осложнения со стороны мягких тканей в виде гиперплазии десенного края над имплантатом на втором этапе имплантации наблюдается у 108 (21,6 %) имплантатов пациентов первой группы и 40 (6,5 %) имплантатов во второй группе. Локальное поражение десенного края (мукозит) без утраты кости вокруг имплантата на втором этапе наблюдалось у 32 (6,4 %) имплантатов пациентов первой группы и 26 (4.2 %) имплантатов пациентов второй группы. В первой группе успех имплантации на первом этапе, когда любые осложнения отсутствуют, наблюдался у 88,2 % имплантатов, во второй группе — у 93,8 % имплантатов. На втором этапе имплантации наблюдается такая закономерность, что увеличение диаметра устанавливаемого имплантата приводит к увеличению полученных осложнений вокруг установленного имплантата. При хронических заболеваниях рост осложнений с увеличением диаметра имплантата более выражен по сравнению с практически здоровыми пациентами (диаграммы № 3, 4).
- Диаграмма № 3. Сравнительная диаграмма осложнений вокруг имплантатов через 36—60 месяцев после имплантации в зависимости от диаметра установленного имплантата у пациентов с хроническими заболеваниями.
- Диаграмма № 4. Сравнительная диаграмма осложнений вокруг имплантатов через 36—60 месяцев после имплантации в зависимости от диаметра установленного имплантата у практически здоровых пациентов.
Обсуждение
Как видно из проведенного исследования, при хронических заболеваниях увеличение осложнений напрямую зависит от диаметра имплантата. Чем меньше диаметр имплантата, тем меньше показатели биологических осложнений вокруг установленного имплантата. И это наблюдается как на первом этапе (диаграмма № 1), так и на втором этапе имплантации (диаграмма № 3).
По нашему мнению, есть прямая зависимость от качественного и количественного состояния кости в зоне имплантации в момент установки имплантата. С общим снижением костной массы в периимплантационной зоне (что связано с подготовкой костного ложа имплантата) больных, не страдающих хроническими заболеваниями, уменьшаются почти все показатели физиологической и репаративной регенерации [6]. При хронических заболеваниях общеорганизменные заболевания у больных ухудшают совокупность морфогистохимических свойств тканевых комплексов (базиса) в зоне имплантата, что следует рассматривать как негативный, неблагоприятный фактор имплантирования. И, следовательно, основным условием имплантации является сохранение максимального количества костной массы вокруг установленных имплантатов. А для создания этих условий необходима минимальная потеря и травма кости. После минимальной препаровки кости создается узкое ложе имплантата, куда можно установить только узкий имплантат. Такая же позиция прослеживается и у других исследователей [9, 10]. И, естественно, чем меньше диаметр имплантата, тем хуже физико-механические свойства имплантата. Основное исследование, которое нам дает возможность определить прочность имплантата и степень нагрузки, которую мы можем дать на остеоинтегрированный имплантат, — это тест на усталостный перелом [11]. Для проведения исследования использовали самый узкий и самый длинный имплантат, соединенный с абатментом с самым большим углом наклона (рис. 1). Имплантаты с абатментами устанавливали на специальную платформу (рис. 2) и применяли направленную нагрузку дозированной силой (рис. 2). Исследования проводили согласно международным требованиям ISO 14801-2007 [12].
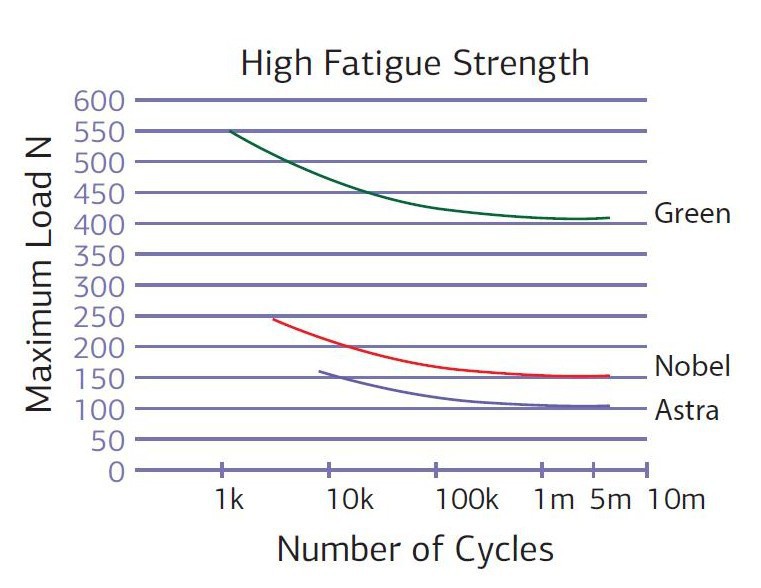
Проведенные исследования на усталостный перелом при статической нагрузке (табл. № 5) дали высокие показатели на прочность от 751N до 838N (график № 1).
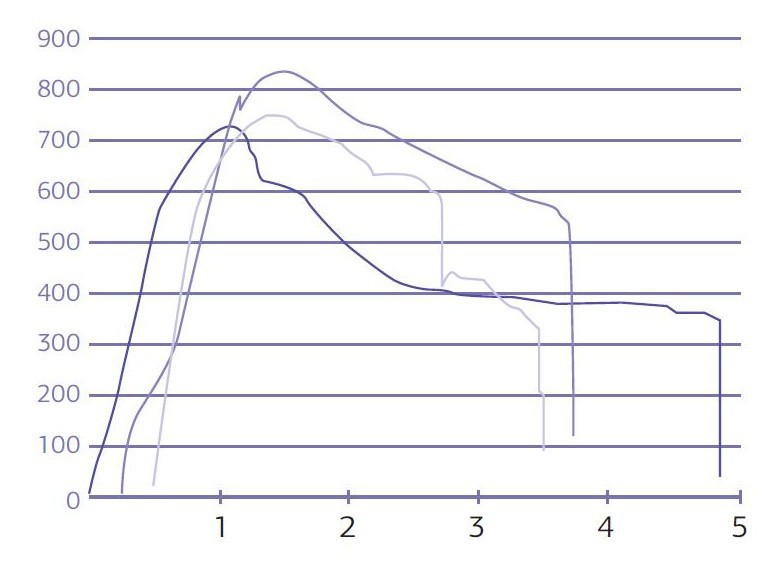
График № 1. Сравнение усталостного перелома узких титановых имплантатов универсал с угловым абатментом при статическом давлении.
При циклической нагрузке (табл. № 6) — показатели 400 N (график № 2).
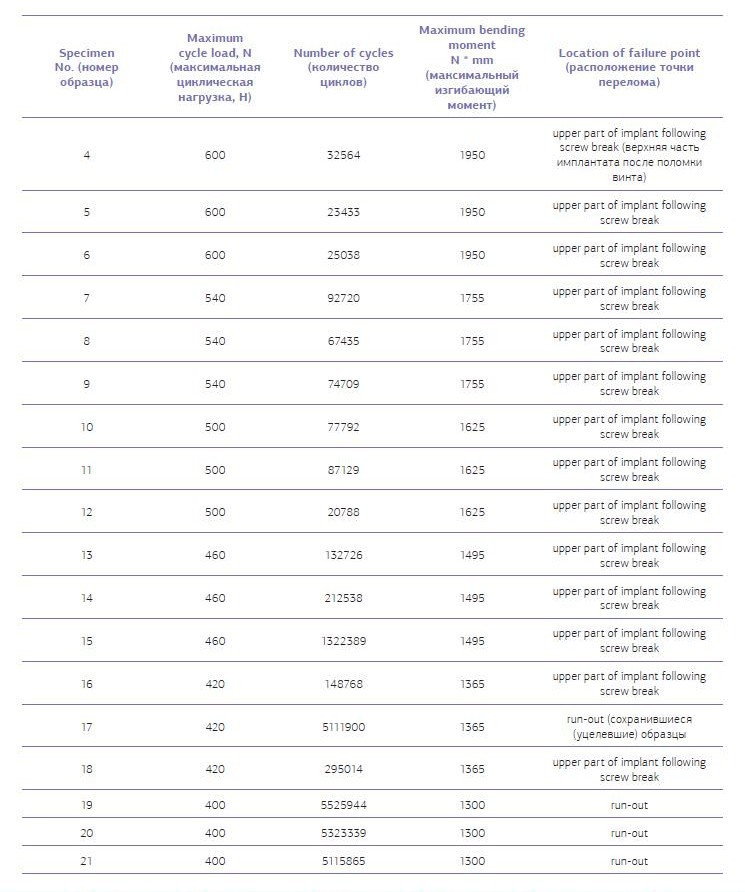
Таблица № 6. Показатели усталостного перелома узких титановых имплантатов универсал с угловым абатментом при циклическом давлении. Необходимым условием являются не менее пяти миллионов циклов не менее чем на трех имплантатах.
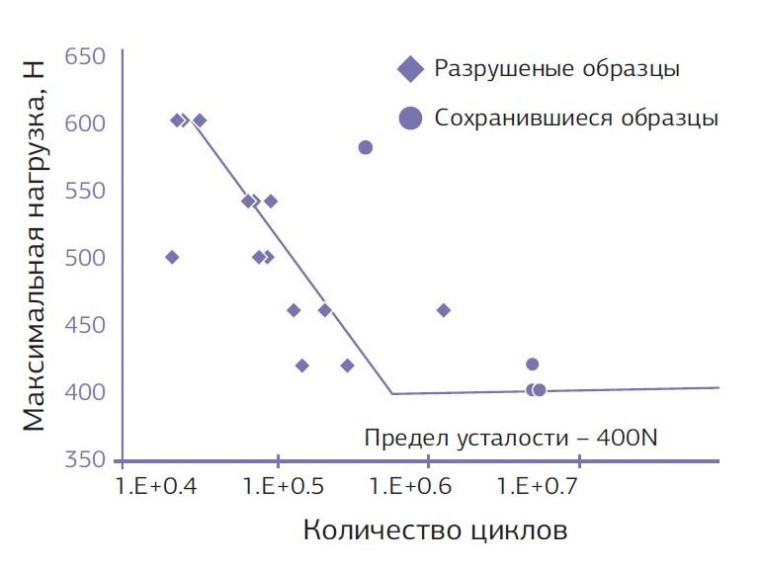
График № 2. Усталостный перелом узких титановых имплантатов универсал с угловым абатментом при циклическом давлении.
При среднепринятых показателях на усталостный перелом при циклической нагрузке, не менее 5 000 000 циклов, лимит около 200N [13, 15]. Узкие имплантаты многих производителей имеют лимит от 100 до 160 N [13—15]. Высокие показатели на усталостный перелом узких имплантатов универсал (диаграмма № 7) дают возможность широко использовать узкие стандартные имплантаты универсал во всех отделах верхней и нижней челюстей и нагружать их как стандартные имплантаты.
Рекомендации при дентальной имплантации пациентов с хроническими заболеваниями
При планировании дентальной имплантации пациентов с хроническими заболеваниями необходимо:
— использование узких имплантатов;
— исключение мостовидных протезов на имплантатах, то есть каждая коронка на имплантате должна иметь свой имплантат для исключения перегрузки.
Выбор методики дентальной имплантации не влияет на успех имплантации. Основными требованиями являются минимальная травма и сохранение массы костной ткани в области имплантации. Для этого в первую очередь необходимо использование нового острого костного сверла. Количество сверл должно быть минимальным для сохранения максимального количества кортикальной кости альвеолярного гребня (кортикальная кость не восстанавливается или восстанавливается частично), но достаточным для правильного формирования костного ложа имплантата. Протоколы сверления костного ложа при хронических заболеваниях необходимо осуществлять по следующим методикам: 1 — маркин сверлом для отметки места сверления (желательно не выравнивать альвеолярный гребень с целью сохранения всей анатомии имеющейся кортикальной кости альвеолярного гребня); 2 — пилотным сверлом диаметром 2 мм по всей длине устанавливаемого имплантата.
И далее нужно учитывать тип кости:
— Тип кости Д4: проходим на глубину 4—6 мм сверлом диаметром 2,8 мм и устанавливаем имплантат универсал диаметром 3,0 мм или проходим зеньковым сверлом диаметром 3,2 мм и устанавливаем имплантат универсал диаметром 3,3 мм (можно установить имплантат респект диаметром 3,75 мм).
— Тип кости Д3: проходим сверлом 2,8 мм на глубину длины устанавливаемого имплантата (при межкортикальной фиксации имплантата до кортикальной кости) и устанавливаем имплантат универсал диаметром 3,0 мм или проходим сверлом диаметром 2,8 мм по всей длине плюс зеньковым сверлом 3,2 мм и устанавливаем имплантат универсал диаметром 3,3 мм (можно установить имплантат респект диаметром 3,75 мм).
— Тип кости Д2: проходим сверлом 2,8 мм на глубину длины устанавливаемого имплантата (при межкортикальной фиксации имплантата до кортикальной кости) и устанавливаем имплантат универсал диаметром 3,0 мм или проходим сверлом диаметром 2,8 мм по всей длине плюс зеньковым сверлом 3,2 мм и устанавливаем имплантат универсал диаметром 3,3 мм.
— Тип кости Д1: проходим сверлом 2,8 мм на глубину длины устанавливаемого имплантата (при межкортикальной фиксации имплантата до кортикальной кости), плюс проходим сверлом диаметром 3,2 мм на глубину ½ длины устанавливаемого имплантата и устанавливаем имплантат универсал диаметром 3,0 мм или проходим сверлом диаметром 2,8 мм плюс по всей длине сверлом 3,2 мм и устанавливаем имплантат универсал диаметром 3,3 мм.
После успешной имплантации пациентам с хроническими заболеваниями следует предлагать индивидуальную программу поддерживающего ухода: прием фармакологических препаратов для терапии общесоматических хронических заболеваний не должен прекращаться до и после имплантации (кроме препаратов для разжижения крови, которые желательно не принимать 5—7 дней до имплантации и продолжить прием на следующий день после имплантации или по согласованию с общим лечащим врачом произвести замещающую терапию); антибиотикотерапия по следующей схеме: прием антибиотика аугментин (по 500 mg 3 раз в день) за 1—2 дня до имплантации и через 7—10 дней после имплантации. При проведении дополнительных процедур по направленной регенерации кости необходимо добавить метронидазол (250 mg 4 раза в день) в течение 5—7 дней; для уменьшения отечности после имплантации необходимо назначить «Дексаметазон» 2 mg (необходимо согласование с лечащим врачом) по схеме в первый день после имплантации по 2 mg 5 раз в день, 2-й день — по 2 mg 4 раза, 3-й день — по 2 mg 3 раза, 4-й день — по 2 mg 2 раза, 5-й день — 2 mg; исключение приема жесткой пищи в течение 15—20 дней после имплантации и прием высококалорийной пищи в течение 2—3 месяцев после имплантации, рекомендуется систематический и продолжающийся мониторинг состояния тканей вокруг имплантата для диагностики состояния твердых и мягких тканей.
Поддерживающую терапию рекомендуется проводить по следующей схеме в зависимости от осложнений вокруг имплантатов [16]:
Протокол 1 является начальным, когда имеются налет и ВОР, но PD составляет 3 мм или менее. В этом случае пациента повторно инструктируют по гигиене полости рта и мотивируют начать и продолжать поддерживающий уход. Выполняется механическое очищение с использованием неметаллических кюреток, проводится полировка резиновым кольцом и неабразивной полирующей пастой.
Протокол 2, когда PD от 4 до 5 мм, состоит в механическом очищении с использованием неметаллических кюреток, проводится полировка резиновым кольцом и неабразивной полирующей пастой и антисептическая обработка с использованием хлоргексидина диглюконата, обычно в форме полосканий полости рта 0.1—0.2%-ным хлоргексидином в течение 30 секунд в количестве приблизительно 10 мл, в форме местных аппликаций геля хлоргексидина (0,2 %) и/или сухой формы хлоргексидина (0,2 %) — периочипса и/или местных ирригаций хлоргексидина (0,2 %) 2 раза в день в течение 3—4 недель [18].
Протокол 3 — когда PD более 5 мм. Следует проводить рентгенографию в дополнение к клиническому обследованию. Лечение состоит в механическом очищении с использованием неметаллических кюреток, полировке резиновыми кольцом и неабразивной полирующей пастой, антисептической обработке с использованием хлоргексидина диглюконата, обычно в форме полосканий полости рта 0.1—0.2%-ным хлоргексидином в течение 30 секунд в количестве приблизительно 10 мл, в форме местных аппликаций геля хлоргексидина (0,2 %) и/или сухой форме хлоргексидина (0,2 %) — периочипса и/или местных ирригаций хлоргексидина (0,2 %) 2 раза в день в течение 3—4 недель, общей терапии, состоящей в назначении аугментина (по 500 mg 3 раз в день) в течение 7—10 дней и метронидазола (250 mg 4 раза в день) в течение 5—7 дней. Местное лечение может включать местное применение антибиотиков при использовании механизма контролируемого высвобождения в течение 10 дней: например, тетрациклиновых нитей и миноциклиновых микросфер, системная или местная терапия антибиотиками применима. После завершения вариантов 1, 2 и 3 может быть рассмотрен хирургический подход 4 [19].
Протокол 4: хирургическое лечение периимплантитов следует сочетать с общей антибактериальной терапией, деконтаминацией или очищением поверхности оголенной части имплантата, или заменой верхней части имплантата (префикс-система имплантата плюс), или заменой всего имплантата. Если избрано регенеративное лечение, то может быть рассмотрено применение мембранной техники изолированно или в комбинации с трансплантацией аутогенных костных частиц и/или заменителей костной ткани. Резекционная хирургия может быть рассмотрена, когда дефект вокруг имплантата не подходит для проведения регенеративных техник.
Выводы
После 3—5 лет 370 пациентов остаются в исследовании. Из 1113 имплантатов выжили 1087 на первом этапе до нагрузки постоянными протезными конструкциями (97.7 %). При этом у пациентов с хроническими заболеваниями из 500 имплантатов выжили 482 (96,4 %), а у практически здоровых пациентов из 613 имплантатов выжили 605 (98 %). В следующий период наблюдения (после нагрузки на имплантаты) из оставшихся 1087 выжили 1062 имплантата (97.7 %). При этом у пациентов с хроническими заболеваниями из оставшихся 482 имплантатов выжили 469 (97,3 %), а у практически здоровых пациентов из 605 имплантатов выжили 593 (98 %). Общий показатель во всех группах и периодах лечения: из 1113 установленных имплантатов выжили 1062, успех имплантации 97,7 %. При этом у пациентов с хроническими заболеваниями из 500 имплантатов выжили 469 (93,8 %), а у практически здоровых пациентов из 613 имплантатов выжили 593 (96,7 %). Показатели общего успеха не отличаются от показателей других исследований [5]. Потеря маргинальной кости вокруг имплантата остается на низком уровне начиная от 0,15 мм (медиальной) до 0,35 мм (дистальной) у узких имплантатов в обеих группах, но с увеличением диаметра имплантата процент потери кости увеличивается, особенно на первом этапе у пациентов с хроническими заболеваниями, и достигает 48,5 % у имплантатов диаметром 6 мм (диаграмма № 5).

Диаграмма № 5. Сравнительная диаграмма осложнений MU вокруг имплантатов после имплантации на разных этапах в зависимости от диаметра установленного имплантата у пациентов с хроническими заболеваниями и практически здоровых пациентов.
Изменения в мягких тканях вокруг имплантатов у пациентов с хроническими заболеваниями имеют больший процент осложнений (диаграмма № 6) по сравнению с показателями практически здоровых пациентов и зависят в основном от общесоматического состояния пациента.
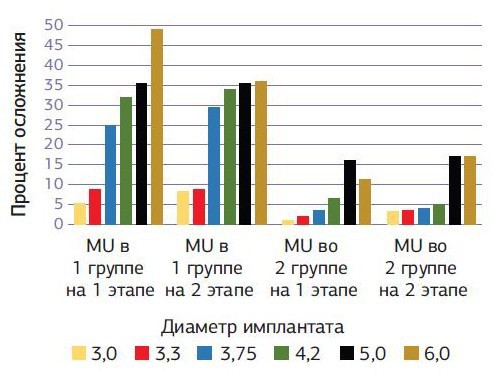
Диаграмма № 6. Сравнительная диаграмма осложнений PI вокруг имплантатов после имплантации на разных этапах в зависимости от диаметра установленного имплантата у пациентов с хроническими заболеваниями и практически здоровых пациентов.
На первом этапе у пациентов с хроническими заболеваниями — за счет пониженных репаративных и общебиологических возможностей организма, а на втором этапе — за счет приема (не в малом количестве) различных фармакологических препаратов, которые приводят к гиперплазии десенного края вокруг имплантатов.
Клинические выводы
Итак, противопоказания для имплантации зубов имеют внушительный перечень, но лишь часть из них относится к таким, которые делают проведение лечения невозможным. Ни наличие хронических заболеваний, ни возраст не являются абсолютным противопоказанием, исключающим дентальную имплантацию, они лишь могут ограничивать применение того или иного вида имплантата или соблюдение особых правил при имплантации. В большинстве же случаев предварительная подготовка, лечение пациента (как местное, так и общее), полная диагностика стоматологического статуса пациента, правильный выбор типа и размера детального имплантата, применение минимально инвазивных методик подготовки костного ложа имплантата и наличие подготовленного медперсонала позволяют успешно избавиться от многих противопоказаний или настолько уменьшить их влияние, что открывается перспектива успешной имплантации зубов. Уменьшение биологических и технических осложнений при имплантации зависит не только от врача-протезиста, но и от врача-хирурга — от выбора количества имплантатов на одной челюсти и вида имплантатов в зависимости от общего статуса пациента.
Замечания по терминам
- Компьютерная томография: CT.
- Панорамная рентгенограмма: PAR.
- Периапикальная рентгенограмма: PER.
- Успех имплантации: SOI-имплантат интегрирован в челюстную кость, отсутствуют подвижность и боли в имплантате.
- Успех SCI: любые осложнения отсутствуют.
- Мукозит (MU): локальное поражение мягких тканей без утраты кости вокруг остеоинтегрированного имплантата.
- Переимплантит (PI): локальное поражение с утратой кости вокруг остеоинтегрированного имплантата.
- Осложнения со стороны мягких тканей (CTC): заживление вторичным натяжением, избыточная припухлость, гиперплазия и т.д.
- Потеря (LOI): имплантат необходимо удалить или его не существует в момент контрольной оценки.
- Глубина зондирования в области имплантата: PD.
- Тест кровоточивости при зондировании: BOP.
Литература
1. Shibli J. A., Aguiar K. C., Melo L., d’Avila S., Zenobio E. G., Faveri M., Iezzi G., Piattelli A. Histological comparison between implants retrieved from patients with and without osteoporosis. Int. J. OralMaxillofac. Surg. 2008; 37 (4): 321—327.
2. Мушеев И. У., Олесова В. Н., Фромович О. З. Практическая дентальная имплантология. Метод. пос. для врачей. — М. 2008. — 500 с.
3. Дедов И. И., Марова Е. И., Рожинская Л. Я. Остеопороз: патогенез, диагностика, принципы профилактики и лечения. Метод. пос. для врачей. — М. 1999. — 62 с.
4. Becker W., Hujoel P., Becker B., Willingham H. Osteoporosis and implant failure: an exploratory case-control study. J. Periodontol. 2000; 71: 625—631.
5 Becker A. R., Handick K. E., Roberts W. E., Garetto L. P. Osteoporosis risk factors in female dental patients. A preliminary report. J. Indian Dent. Assoc. 1997; 76 (2): 15—19.
6. Roberts W. E., Simmons K. E., Garetto L. P., DeCastro R. A. Bone physiology and metabolism in dental implantology: risk factors for osteoporosis and other metabolic bone diseases. Implant. Dent. 1992; 1 (1): 11—21.
7. А. Р. Агазаде, И. А. Гасанов, Р. Р. Агазаде. Гистоморфометрический и количественный гистохимический анализ периимплантатной зоны у больных с различной минеральной плотностью костной ткани при дентальной имплантации. Вестник РАМН. — 2014, № 3—4. 19—23. Баку.
8. Юнкеров В. И., Григорьев С. Г., Резванцев М. В. Математико-статистическая обработка данных медицинских исследований. — СПб.: ВмедА, 2011. — 318 с.
9. Arisan V, Bölükbas¸i N, Ersanli S, Ozdemir T. Evaluation of 316 narrow diameter implants followed for 5—10 years: a clinical and radiographic retrospective study. Clin Oral Implants Res 2010; 21:296—307.
10. Sohrabi K, Mushantat A, Esfandiari S, Feine J. How successful are small-diameter implants? A literature review. Clin Oral Implants Res 2012; 23:515—525.
11. Lee CK1, Karl M, Kelly JR. Evaluation of test protocol variables for dental implant fatigue research. Dent Mater. 2009 Nov; 25(11):1419-25. doi:10. 1016/j. dental. 2009. 07. 003. Epub 2009 Jul 30.
12. ISO 14801. Fatigue Test for Endosseous Dental Implants. Geneva: International Organization for Standardization, 2007.
13. Bathias C. There is no infinite fatigue life in metallic materials. Fatigue FractEngng Mater Struct 1999; 22:559—565.
14. Quek CE, Tan KB, Nicholls JI. Load fatigue performance of a single-tooth implant abutment system: effect of diameter. Int J Oral Maxillofac Implants 2006; 21:929—936.
15. Keren Shemtov-Yona, Daniel Rittel, Liran Levin, Eli E. Effect of Dental Implant Diameter on Fatigue Performance. Part I: Mechanical Behavior . 2012 Wiley Periodicals, Inc. DOI 10. 1111/j. 1708—8208. 2012. 00477. x
16. Lang NP, Wilson TG, Corbet EF. Биологические осложнения дентальных имплантатов: их профилактика, диагностика и лечение. Clin Oral Implant Res 2000; 11(suppl 1): 146—155.
17. Ю. Ю. Яров, Ю. И. Силенко. Поддерживающее лечение после дентальной имплантации // Український стоматологічний альманах. — 2014, № 5—6. — С. 71—74.
18. Heitz—MayfieldLJA, LangNP. Антибактериальное лечение периимплантитов. J Oral Maxillofac Implants 2004; 19 (suppl): 128—139.
19. Schou S, Berglundh T, Lang NP. Хирургическое лечение периимплантитов. J Oral MaxillofacImplants 2004; 19 (suppl): 140—149.
Статья была опубликована в журнале Дента клуб № 2 (55), 2016