О некоторых возможностях современных компьютерных технологий в челюстно-лицевой хирургии
А. Н. Чуйко
к. т. н., доцент (Харьков)
Д. К. Калиновский
к. м. н., доцент (Донецкий НМУ им. М. Горького)
Введение
Современные компьютерные технологии в медицине вообще и в челюстно-лицевой хирургии в частности базируются на компьютерной томографии (CT) и CAD/CAM-технологиях, которые пришли в медицину практически одновременно, в 80-х годах прошлого столетия.
Созданная лауреатами Нобелевской премии (1979) Г. Хаунсвилдом и А. Кормаком CT не только стала одним из важнейших методов диагностики в медицине, но и заложила основу в построении трехмерных (3D) изображений исследуемых объектов. В настоящее время широко рекламируются программные системы SimPlant, Implant-assistant, 3D-DOCTOR, MIMICS (Materialise) и др., которые позволяют от 2D компьютерных срезов перейти к 3D-объектам с возможностью структурного анализа системы в зависимости от плотности кости. К сожалению, до сих пор очень часто CT позиционируется в основном как система по диагностике, в том числе в челюстно-лицевой хирургии и хирургической стоматологии.
CAD/CAM-технологии как элементы систем автоматизированного проектирования пришли в стоматологию из техники. Родоначальником принято считать Мэтта Андерсона, который в 1981 году применил первую систему CAD/CAM при производстве титановых каркасов мостовидных протезов. Базируются современные достижения в биомеханике, в первую очередь, на современных компьютерных технологиях — системах CAD/CAM/CAE. CAD (Computer Aided Design) — компьютерный дизайн или компьютерное конструирование; CAM (Computer Aided Mechanics) — компьютерная помощь в производстве, включая передачу информации в центр изготовления изделия; CAE (Computer Aided Engineering) — компьютерная помощь в инженерных расчетах, как правило, на базе метода конечных элементов (МКЭ).
Особенно плодотворным оказалось применение специализированных программ по оценке напряженно-деформированного состояния (НДС) технических систем, основанных на таком современном методе механико-математического моделирования, как метод конечного элемента (МКЭ). МКЭ — международный стандарт для решения задач механики твердого тела посредством численных алгоритмов. Достаточно сказать, что ни один мост, ни один самолет и т. п. не сертифицируются международными организациями, если они рассчитаны без применения этого метода. В последние годы этот метод получает все большее применение в биомеханике вообще, а также в челюстно-лицевой хирургии и стоматологии в частности. Об этом свидетельствуют многочисленные статьи и материалы последних международных конгрессов, конференций и симпозиумов. В медицине, как и в технике, широко используются программные комплексы ANSYS, ABAQUS, SolidWorks/COSMOSWorks и др.
Как всегда при развитии в науке и технике, одно достижение вызывает развитие в других смежных областях. Конечно-элементное моделирование и анализ в медицине получают новые практически неограниченные возможности, если оно строится на базе компьютерной томографии, так как появляется возможность строить не канонические или идеализированные модели, а модели, максимально приближенные к конкретному пациенту как по геометрии, так и по свойствам мягких и костных тканей. Вся система CAD/CAM/CAE — это, с одной стороны, система знаний, базирующаяся на инженерном подходе. С другой стороны, система CAD/CAM/CAE — сложный комплекс разных компьютерных программ, и их освоение, как теоретическое, так и практическое, требует и времени, и методического обеспечения. Все современные компьютерные технологии построены на численных математических методах. Очевидно, знать их суть врачу трудно и, возможно, необязательно. Но уметь готовить исходные данные, анализировать и внедрять полученные результаты — необходимо. В медицине широко распространены качественные оценки: «латерально», «медиально» и т. п. Например, можно сказать: человек средних лет, среднего роста и средней комплекции. Такое определение хорошо звучит в художественной литературе. В научной статье по биомеханике гораздо конкретнее будет звучать: мужчина, 42 лет, рост — 175 см, вес — 82 кг. Любое компьютерное моделирование требует больших массивов исходных данных, выраженных численно. Работать с числом (его размерностью, знаком, порядком) — удел любого специалиста, обращающегося к биомеханике.
В одном программном комплексе могут быть соединены различные системы CT/CAD/CAE. В нашем случае объединение возможностей программных систем MIMICS (Materialise) и SolidWorks/COSMOSWorks, которым мы отдаем предпочтение по ряду их технологических возможностей, дает в руки исследователей и практикующих врачей мощный инструмент, позволяющий не только обоснованно планировать операцию, но и прогнозировать ее как ближайшие, так и отдаленные результаты. Практически эта система предложена в [1] при анализе возможности разработки стоматологии без оттисков, на примере мостовидного протеза, и при исследовании особенностей конструирования, фиксации и стабилизации субпериостальных имплантатов в [2]. Предлагаемая система CT/CAD/CAE/CAM может быть использована челюстно-лицевыми хирургами, ортопедами-стоматологами, имплантологами, ортодонтами, в ортопедии позвоночника и суставов и т. п., позволяя моделировать любые элементы реконструкции, не вскрывая предварительно операционное поле.
Целью предлагаемой работы является демонстрация возможностей современных компьютерных технологий на примере некоторых конкретных челюстно-лицевых операций.
Особенности челюстно-лицевых операций на нижней челюсти
Нижняя челюсть (НЧ) человека является одной из наиболее травмируемых частей человеческого организма, несмотря на то что в процессе эволюционного развития «человек получил в подарок одну из самых прочных своих деталей». Здесь бытовые травмы по количеству и разнообразию конкурируют с производственными и со спортивными травмами, особенно в таких современных видах спорта, как бокс, кикбоксинг, американский футбол и пр. Лечение травм костей лицевого скелета, среди которых превалируют переломы нижней челюсти (как изолированные, так и сочетанные с другими повреждениями), требует внимания специалистов разного профиля, прежде всего челюстно-лицевых хирургов и стоматологов-ортопедов.
В последнее время все большое значение в связи с предоставляемыми возможностями по оценке предоперационного состояния и отдаленных результатов лечения приобретает биомеханический анализ, построенный на базе таких современных достижений науки, как компьютерная томография и твердотельное моделирование с последующим конечно-элементным анализом.
В предлагаемом исследовании предполагается комплексное использование в основном двух программ: MIMICS и SolidWorks. Несмотря на то что это принципиально разные программы, целый ряд команд, инструментов и возможностей совпадает, и применяться они будут с позиций рациональности при решении конкретной задачи. Терминология также будет варьироваться, то есть остеотомия кости — это разрез (рассечение) твердотельной детали, репозиция или репонирование — это перемещение детали или элемента, как линейное, так и угловое, и т. п.
Рассмотрим эти положения на примере нескольких клинических случаев.
Клинический случай № 1
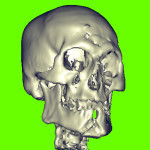
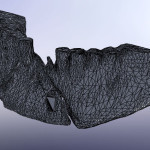
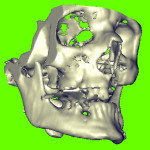
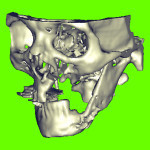
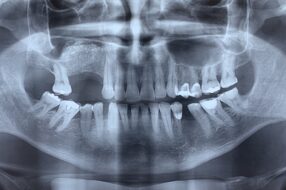
Пациент М., 38 лет, госпитализирован в клинику по поводу сочетанной черепно-мозговой и челюстно-лицевой травмы. Среди повреждений костей лицевого скелета имели место переломы верхней и нижней челюсти (рис. 1.1). На нижней челюсти — двусторонний перелом в ментальном отделе со смещением срединного фрагмента вниз и назад. В предлагаемом исследовании основное внимание уделим двустороннему перелому НЧ.
- Рис. 1.1. Сочетанная травма верхней и нижней челюсти пациента М.
- Рис. 1.2. Вид челюсти спереди.
- Рис. 1.3. Вид челюсти снизу.
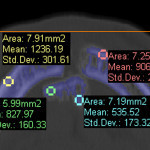
- Рис. 1.4. Числа Хаунсфилда (в строке Mean) для рассматриваемого фрагмента НЧ.
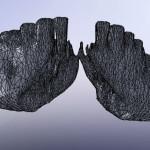
- Рис. 1.5. Боковые (большие) фрагменты нижней челюсти.
- Рис. 1.6. Малый (срединный) фрагмент челюсти.
- Рис. 1.7. «Сборка» НЧ, фронтальный вид.
- Рис. 1.8. «Сборка» НЧ, вид снизу.
- Рис. 1.9. «Сборка» НЧ в изометрии.
- Рис. 1.10. «Сборка» НЧ с зоной интерференции.
- Рис. 1.11. Эскизы вариантов остеосинтеза.
Здесь и далее с целью уменьшения объема задачи, то есть необходимых ресурсов компьютера для используемых программ, будем рассматривать только те фрагменты скелета человека, которые отражают все особенности рассматриваемой травмы.
На рис. 1.2 и 1.3 представлен результат сегментации НЧ пациента при виде спереди и снизу. Следует отметить (рис. 1.3), что, очевидно, к моменту проведения СКТ — через неделю после получения травмы (после стабилизация неврологического статуса) — с целью планирования оперативного лечения на костях лицевого скелета произошло сращение срединного фрагмента нижней челюсти с боковым фрагментом. В таком виде следующий шаг в рассматриваемой методике — генерирование STL-файла с открытием его программой SolidWorks как твердого тела — невозможен из-за избыточного количества образующих плоскостей. Это один из критических моментов рассматриваемой технологии, который следует учитывать в дальнейшем, требующий дополнительных подготовительных операций средствами программы MIMICS.
- Рис. 1.12. Нижняя часть НЧ в зоне имплантата.
- Рис. 1.13. Нижняя часть НЧ с имплантатом.
- Рис. 1.14. Имплантат — пластина реконструктивная типа 101.02 из набора системы «КОНМЕТ».
- Рис. 1.15. Эскизы направляющих кривых и профилей.
- Рис. 1.16. Эскизы направляющих кривых и профилей.
- Рис. 1.17. Итоговые эскизы направляющих кривых и профилей.
- Рис. 1.18а. Сетчатый имплантат при виде спереди.
- Рис. 1.18б. Сетчатый имплантат при виде сверху.
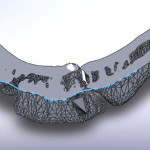
Одной из замечательных особенностей программы MIMICS является возможность определять плотность костных тканей по оттенкам серого в соответствии со шкалой Хаунсфилда. Один из результатов такого анализа представлен на рис. 1.4.
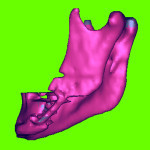
- Рис. 2.1а. 3D-модель костей лицевого скелета пациента К., вид справа.
- Рис. 2.1б. 3D-модель костей лицевого скелета пациента К., вид справа слева.
- Рис. 2.2а. Проекция НЧ справа.
- Рис. 2.2б. Проекция НЧ справа фронтальная.
- Рис. 2.2в. Проекция НЧ левая.
- Рис. 2.3а. НЧ при варьировании порогов чисел HU.
- Рис. 2.3б. НЧ при варьировании порогов чисел HU.
- Рис. 2.4. Левая ветвь НЧ после остеотомии.
- Рис. 2.5. Совмещение левой ветви с правой.
- Рис. 2.6. 3D-модель костного трансплантата.
- Рис. 2.7. STLV-модель костного трансплантата.
- Рис. 2.8. 3D-модель фрагмента челюсти.
- Рис. 2.9. STLV-модель фрагмента челюсти.
- Рис. 2.10. Сечение фрагмента челюсти.
- Рис. 2.11. Этап моделирования имплантата
- Рис. 2.12. Модель имплантата.
Как следует из данных рис. 1.4, значения плотности в отмеченных зонах, где предполагается установка винтов фиксации имплантата, ближе к нижнему значению диапазона (HU = 586… 2198) для компактной кости по статистическим данным (рис. 4.8.1 [2]). В нижней части малого отломка (на рис. 1.4) значение HU соответствует губчатой кости. Можно предположить, что это артефакт, образовавшийся в результате травмы НЧ.
С одной стороны, такой анализ, с составлением необходимой хирургу «карты плотности», может быть проведен для любой точки скелета по осевым, фронтальным и сагиттальным сечениям. С другой стороны, эти данные с использованием методики, изложенной в [2], позволяют определять основные механические характеристики костных и мягких тканей, необходимые при конечно-элементном моделировании и анализе, фактически в режиме реального времени.
Далее средствами программы MIMICS проведена остеотомия с разделением НЧ на два фрагмента. Для каждого из фрагментов получен STL-файл, который открыт программой SolidWorks как твердое тело.
В работе [2] такого типа модели названы STLV — виртуальная стереолитографическая модель. На наш взгляд, использование этих моделей предпочтительнее, чем традиционных, так как они не требуют дополнительного оборудования и материалов, а по точности превосходят модели, получаемые по технологиям быстрого прототипирования. Их точность определяется математическим аппаратом, заложенным в программах MIMICS и SolidWorks, и не зависит от используемого оборудования, материала и квалификации исполнителя. В то же время они являются твердотельными, то есть им можно придавать любые механические характеристики; обрабатывать средствами программы SolidWorks, включая получение литейных форм созданной модели; подвергать испытаниям под нагрузкой, при любых температурных режимах и т. п.
Отметим, что программа SolidWorks в режиме «сборка» позволяет определять зоны интерференции (взаимного пересечения частей), одна из которых показана на рис. 1.10. На наш взгляд, она соответствует артефакту, обнаруженному на рис. 1.4. У хирурга появляется возможность при подготовке к операции увидеть фрагменты, требующие коррекции и адаптации.
На рис. 1.11 представлены эскизы возможных вариантов остеосинтеза. Кратко их обсудим, начав с нижнего, предполагающего использование двух мини-пластин. Чтобы исключить «мгновенную изменяемость системы» [2], каждая из мини-пластин должна быть прикреплена к отломкам как минимум с использованием трех винтов (двух на одном из концов пластины) с оптимальным, с точки зрения прочности, расстоянием между ними и краем перелома. Более обстоятельно этот вопрос рассмотрен в [2]. Расположение по два винта на каждой стороне большого отломка приведет к увеличению общего расстояния между крайними концами пластин (длины мини-пластин), то есть к повышению травматичности операции. На малом отломке размещать четыре винта просто негде. Решение задачи выглядит более рационально, если вместо двух мини-пластин использовать одну пластину реконструктивную типа 101.02 из набора реконструктивных титановых пластин «КОНМЕТ» (Москва). Тогда на малом отломке следует разместить два винта и по одному с каждой из сторон на большом отломке. Система будет жесткой, то есть мгновенно неизменяемой, но с меньшей общей длиной реконструктивной пластины.
Второй вопрос, требующий обсуждения, — толщина пластины реконструктивной. По каталогу «КОНМЕТ» все пластины этого типоразмера имеют толщину 3,2 мм, что и отражено (в масштабе) на рис. 1.13 и 1.14. В работе [2] все пластины рекомендовано условно разделять на силовые и технологические. Если пластина реконструктивная силовая, как обозначено стрелкой на рис. 1.11, то ее параметры, в том числе поперечные размеры, должны определяться из условия прочности, которое достаточно обстоятельно на примере мини-пластин рассмотрено в [2]. Если нагрузка на пластину реконструктивную небольшая, то ее толщина (по каталогу) может быть избыточной. Тогда следует рекомендовать фирме «КОНМЕТ» расширить ряд типоразмеров пластин реконструктивных с различной толщиной. Этот вопрос, на наш взгляд, не является формальным, так как «чем больше металла во рту», тем хуже кровоснабжение окружающих имплантат тканей. Кроме того, изгиб мини-пластин «вручную» более точно можно осуществить для тонких пластин.
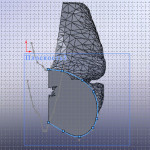
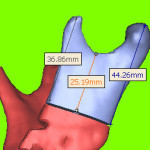
После осознанного рассмотрения этих вопросов можно приступить и к проектированию имплантата. На рис. 1.12. показана нижняя часть НЧ в зоне имплантата с направляющей кривой. Поперечное сечение имплантата, в соответствии с каталогом «КОНМЕТ», принято 8х3,2 мм. На рис. 1.13. показана нижняя часть НЧ с имплантатом. Расстояние между торцами равно 53,89 мм, то есть из каталога наиболее подходит реконструктивная титановая пластина 101.02. Заготовка для имплантата (без перфорационных отверстий) показана на рис. 1.14.
К спроектированной конструкции имплантата следует сделать следующие дополнения:
1. Если на уровне верхнего торца рассечь челюсть еще одной плоскостью, то можно провести еще одну направляющую кривую. Тогда при «движении» профиля поперечного сечения по направляющим кривым оно будет поворачиваться (закручивать титановую пластину) в соответствии с реальной анатомической поверхностью НЧ в этой зоне. Прилегание имплантата к кости будет более точным.
2. Отсутствие перфорационных отверстий на титановой пластине объясним следующим образом. В принципе следует различать отверстия перфорационные и под фиксирующие винты, которые могут быть разного диаметра. Отверстия под фиксирующие винты и сами винты можно выполнять по прецизионным технологиям, что обеспечит лучшую первичную фиксацию имплантата.
3. При учете первых двух замечаний конструкция имплантата будет достаточно сложной, и тогда можно рекомендовать индивидуальную технологию его изготовления. Программа SolidWorks позволяет моделировать литейные формы для изделий, созданных ее средствами [2].
На рис. 1.11 (сверху) приведен эскиз сетчатого имплантата, конструкции, которая получает широкое распространение в клинической практике. Основные этапы подготовительной работы по его моделированию представлены на рис. 1.15—1.17.
Отметим, что эта работа может быть достаточно трудоемкой в зависимости от сложности проектируемой конструкции и заданной точности. Итоговые эскизы направляющих кривых и профилей, представленные на рис. 1.17, позволяют получить заданную поверхность и смоделировать сетчатый имплантат, который показан на рис. 1.18.
Замечания по имплантату, представленному на рис. 1.14, можно дополнить — появляется возможность изготовить литейную форму не только для имплантата, но и для шаблона из любого конструкционного материала, по которому может быть изготовлен путем обжатия (пластического деформирования стандартной пластинки) сетчатый имплантат с поверхностью любой сложности. Следует только учитывать возможность последующей сборки (установки) имплантата с НЧ.
Сравнение рис. 1.14 и 1.18б показывает, что конфигурация передней кромки имплантатов идентична.
У челюстно-лицевого хирурга появляется возможность выбора одной конструкции имплантата для НЧ из двух — пластины реконструктивной или сетчатого имплантата — в соответствии с теми представлениями и техническими возможностями, которые у него сложатся при подготовке операции.
Методика приближенного расчета сетчатого имплантата на прочность приведена в [2]. При необходимости более точного анализа на прочность и жесткость полученная конструкция (рис. 1.18) может служить основой для конечно-элементного моделирования и анализа.
Клинический случай № 2
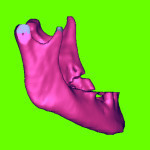
Пациент К., 40 лет, госпитализирован в клинику с последствиями сочетанной черепно-мозговой и челюстно-лицевой травмы спустя 4 месяца после получения травмы. На первичном этапе лечения (до госпитализации в клинику) в челюстно-лицевом стационаре по м/ж пациента производилась первичная хирургическая обработка костных ран и ран мягких тканей, остеосинтез нижней челюсти слева с использованием шва кости полиамидной нитью. Вследствие ряда негативных факторов (тяжесть травмы, оскольчатая форма перелома, нестабильность первичной фиксации и пр.) развился травматический остеомиелит нижней челюсти слева, вследствие чего спустя 2 месяца там же (в челюстно-лицевом стационаре по м/ж) проведены секвестрэстомия и остеосинтез нижней челюсти с использованием металлической скобы. К сожалению, и повторная фиксация оказалась нестабильной, в связи с чем больной направлен на консультацию и дальнейшее лечение в областную клинику челюстно-лицевой хирургии. В плане предоперационной подготовки с целью планирования объема предстоящего оперативного лечения проведена СТ с 3D-реконструкцией костей лицевого скелета. Указанная 3D-модель представлена на рис. 2.1. К сожалению, головка правого ВНЧС в зону CT попала не полностью.
По данным CT, у пациента имеется дефект тела и угла нижней челюсти слева, смещение малого фрагмента (ветви нижней челюсти слева) вперед и вверх.
Основное внимание сосредоточим на решении следующих задач.
1. Репозиция фрагментов, в первую очередь головки левого ВНЧС, в положение, близкое к анатомическому.
2. Моделирование (размеров и формы) костного трансплантата для адекватного восстановления дефекта тела и угла нижней челюсти слева.
3. Проектирование имплантата для функциональной взаимосвязи фронтальной части челюсти с ветвью нижней челюсти слева.
Для более детального анализа приведем и другие изображения, полученные при расшифровке данных CT. На рис. 2.2 представлены три проекции НЧ после ее сегментации, которые показывают степень смещения левой ветви и размер дефекта тела челюсти.
Следуя методике, изложенной выше, была предпринята попытка создать для НЧ STL-файл, чтобы открыть его программой SolidWorks как твердое тело. К сожалению, эта попытка успехом не увенчалась даже при варьировании порогов чисел HU, которые представлены на рис. 2.3а, б. Такая сложная конструкция открывается программой SolidWorks только как геометрическое тело (рис. 2.3в), которое не может быть использовано, так как имеет ограниченные возможности.
Далее возможны разные подходы. Можно, пользуясь средствами MIMICS, провести остеотомию челюсти на отдельные фрагменты, получить для них STL-файлы и передать их в SolidWorks с последующей сборкой в единое целое. К сожалению, последовательное выполнение перечисленных выше задач невозможно. Поэтому будем решать их во взаимосвязи, чередуя возможности обеих программ.
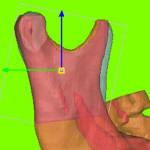
Вначале, используя MIMICS, проведем остеотомию левой ветви нижней челюсти (рис. 2.4).
К этой части операции следует отнестись с особым вниманием, так как это действие придется проводить не только виртуально, но и реально. Для облегчения работы хирурга на рис. 2.4 приведены расстояния от разреза до наиболее характерных точек ветви.
Производим совмещение остеотомированной левой ветви с правой (рис. 2.5), изменив прозрачность челюсти. За приоритетное положение принято совмещение головок и нижнего края левой ветви с правой. На рис. 2.5 хорошо видно, насколько пришлось сместить левую ветвь НЧ. Виртуальное сечение правой части челюсти должно совпадать с сечением на левой части с высокой точностью, так как этим будет определяться точность верхней кромки костного трансплантата при моделировании его размеров и формы.
По этой же причине с той же тщательностью следует провести сечение, которое будет определять положение нижней кромки костного имплантата. В этом случае копирование можно проводить как слева направо, так и справа налево (при условии симметрии фронтальной части челюсти). Результаты проведенной работы по моделированию костного трансплантата приведены на рис. 2.6 и 2.7. На рис. 2.7 показана STLV-модель, построенная по 3D-модели правой части челюсти, но уже в среде SolidWorks. Можно сделать ее зеркальное отображение и продолжить моделирование. При этом следует учитывать, что на левой стороне пока нет зубов и высота фронтальной части челюсти справа и слева разная (рис. 2.2б). Очевидно, на этом этапе к работе необходимо привлечь стоматолога-ортопеда и имплантолога. Особо подчеркнем, что при любых манипуляциях положение и ориентация плоскостей на торцевых кромках костного трансплантата (рис. 2.7) должны сохраняться, так как этим будет определяться точность последующей «сборки».
Для продолжения процесса моделирования имплантата для функциональной взаимосвязи фронтальной части челюсти с ветвью нижней челюсти слева проведем очередную сегментацию НЧ, выделив в виде одного фрагмента правую и фронтальную часть челюсти. 3D-модель этого фрагмента приведена на рис. 2.8, а на рис. 2.9 — STLV-модель. В дальнейшем она послужит шаблоном для моделирования пластины реконструктивной.
Завершающие действия по моделированию пластины реконструктивной приведены на рис. 2.10, 2.11 и 2.12.
На рис. 2.10 показано сечение фрагмента челюсти, по кромке которого моделируется имплантат. На рис. 2.11 приведен один из этапов моделирования имплантата. На одном из таких этапов можно определить контрольные расстояния между характерными точками имплантата и НЧ. На рис. 2.12 приведена окончательная заготовка для имплантата после зеркального отражения модели, построенной по правой части челюсти, которая послужила шаблоном. Конструкция имплантата может быть выполнена более точной, прилегающей к поверхности челюсти в соответствии с ее анатомическими неровностями, если провести дополнительные сечения, на которых построить дополнительные направляющие.
В случае большой сложности спроектированного имплантата можно, как и выше, рассмотреть технологию изготовления индивидуального имплантата путем создания его литейных форм с помощью программы SolidWorks.
Таким образом, все поставленные выше задачи: по репозиции фрагмента левой головки ВНЧС в положение, близкое к анатомическому; моделированию костного трансплантата для восстановления дефекта тела и угла нижней челюсти слева и проектированию имплантата для функциональной взаимосвязи фронтальной части челюсти с левой ветвью нижней челюсти — выполнены. Можно предположить, что лечащий врач ограничится одним из возможных вариантов реконструкции: 1) установит костный трансплантат, который позволит «собрать» левую часть челюсти в конфигурацию, близкую к анатомической; 2) установит костный трансплантат и пластину реконструктивную; 3) ограничится установкой пластины реконструктивной с расположением жизнеспособных осколков «по месту».
На наш взгляд, при первом варианте должны быть произведены расчеты на прочность либо по приближенной методике [2, 3], либо — более точно — на основе конечно-элементного моделирования и анализа. Для третьего варианта сомнения вызывают жесткость всей конструкции и прочность, особенно в зоне фиксирующих винтов крепления имплантата к фронтальной части челюсти, так как винты будут «выворачиваться». В [2] установлено, что фронтальная часть челюсти и в норме «работает» на кручение, что и «заставило» эволюцию сделать ее более массивной. Только расчеты на прочность и жесткость либо по приближенной методике [2, 3], либо — более точно — на основе конечно-элементного моделирования и анализа позволят ответить на вопрос о рациональности и долговечности проведенной реконструкции.
Заключение
Из предложенной в [2] и во введении CT/CAD/CAE/CAM-системы в проведенном исследовании активно использованы только две ее составляющие — CT/CAD — с их конкретной реализацией, заложенной в программах MIMICS и SolidWorks. Возможность использования составляющих CAE/CAM только намечена — при необходимости более глубокого анализа прочности и жесткости и при необходимости изготовления индивидуальных имплантатов.
Предлагаемая система CT/CAD/CAE/CAM может быть использована челюстно-лицевыми хирургами, стоматологами-ортопедами, имплантологами, ортодонтами, травматологами-ортопедами и др., позволяя моделировать любые элементы реконструкции, не вскрывая предварительно операционное поле.
Следует ожидать существенных изменений в уровне подготовки и характере работы черепно-челюстно-лицевых хирургов, с опорой на современные компьютерные технологии.
Для биомеханического обоснования принимаемых решений, особенно на этапе планирования операции, в бригаду должен входить специалист, владеющий основами биомеханики хотя бы в степени, достаточной для проведения необходимых расчетов.