Опыт применения богатой тромбоцитами плазмы T-Lab в лечении пациента с пародонтитом
М. С. Варварюк
Врач стоматолог-хирург, имплантолог, специалист клиники МЕЛИС (Москва)
С. Г. Булат
к.м.н, челюстно-лицевой хирург, специалист клиники МЕЛИС (Москва)
Регенеративная терапия представляет большой интерес в области биотехнологии. Включая в себя различные отрасли медицины, в частности – хирургию, стоматологию, клеточную и молекулярную биологию, биоматериалы и тканевую инженерию, ее целью является достижение регенерации, репарации или замещения тканей [9].
Регенеративная, или восстановительная стоматология, в свою очередь, являясь неотъемлемой частью медицины, объединяет и применяет в клинической практике результаты исследований в области стволовых клеток, клеточной инженерии и стоматологической науки в целом. В ее задачи входит применение биологических механизмов для поддерживания целостности либо регенерации поврежденных тканей полости рта и восстановлении их функций.
Дефекты мягких и твердых тканей челюстно-лицевой области и, в частности, полости рта чаще всего появляются в результате воспаления, травмы, опухолевого роста, врожденных аномалий. Общепринятыми методами их устранения являются применение аутогенной костной ткани и мягкотканных лоскутов. Все же, их использование сопряжено с целым рядом сложностей и рисков [34].
Тромбоцитарные концентраты изначально использовались в трансфузиологии для предупреждения и лечения при кровотечениях, возникающих вследствие выраженной тромбоцитопении. Богатая тромбоцитами плазма (БТП; PRP – platelet-rich plasma) была позже внедрена в качестве инновационного аутогенного продукта крови, способного улучшить заживление и регенерацию тканей [9].
В настоящее время терапия PRP широко применяется в таких отраслях медицины, как ортопедия, дерматология, косметология, стоматология, репродуктология, спортивная медицина, кардиохирургия, торакальная хирургия, челюстно-лицевая и пластическая хирургия [9]. Доказана эффективность применения плазмотерапии в ремоделировании костной ткани; заживлении ран, в том числе диабетических; стимуляции роста волос; регенерации нервной ткани; омоложении кожи; сглаживании рубцов постакне.
В клинической практике применяются четыре варианта тромбоцитарных концентратов, которые классифицируются относительно содержания в себе лейкоцитов и фибрина следующим образом:
- чистая богатая тромбоцитами плазма (PRP);
- богатая лейкоцитами и тромбоцитами плазма (L-PRP – leukocyte and
platelet-rich plasma); - чистый богатый тромбоцитами фибрин (PRF – platelet-rich fibrin или – P-PRF – pure platelet-rich fibrin);
- богатый лейкоцитами и тромбоцитами фибрин (L-PRF – leukocyte and platelet-rich fibrin).
Эти четыре вида продукта имеют различную биологическую структуру и механизм действия, соответственно – различные показания к клиническому применению [9].
Богатая тромбоцитами плазма определяется как аутогенный концентрат тромбоцитов в небольшом объеме плазмы, являющимся богатым источником аутогенных факторов роста [22]. БТП была впервые внедрена в челюстно-лицевую хирургию Whitman и колл. в 1997 году в виде геля, как альтернатива фибриновому клею [36]. Впоследствии, в 1998 году, Marx и колл. сообщили об успешном применении БТП в комбинации с аутогенными костными блоками в реконструкции при устранении дефектов нижней челюсти. Исследование авторов доказало, что добавление БТП к аутокостным блокам приводило к ускоренному созреванию костной мозоли и достижению большей плотности кости, в сравнении с применением при реконструкции только костных блоков [20].
С течением времени терапия БТП стала набирать популярность и показывать хорошие результаты в регенеративной стоматологии, в том числе в эндодонтии (при пульпотомии, апексификации, апикальной хирургии), пародонтологии (при устранении костных дефектов, костной пластике), челюстно-лицевой хирургии (при удалении зубов, хирургии мягких и костной тканей, имплантологии) [1, 16, 23].
Итак, БТП представляет собой аутогенный биологический продукт – фракцию плазмы крови с концентрацией тромбоцитов выше, чем их содержание в исходной цельной крови [9]. БТП является тромбоцитарным концентратом первого поколения, получаемым из свежей венозной крови путем центрифугирования, и содержащим не менее 1.000.000 тромбоцитов на μL [21, 35]. В качестве аутогенного биоматериала БТП характеризуется отсутствием токсического и иммунного воздействия на ткани и организм в целом [19, 20].
Заживляющая и регенеративная способность БТП проявляется благодаря постоянному местному высвобождению большого числа различных факторов роста, необходимых для течения данных физиологических процессов. Известно, что факторы роста являются биологическими медиаторами в регуляции клеточных событий (миграции, пролиферации, дифференциации), синтеза внеклеточного матрикса, а также ангиогенеза [4, 15, 28].
Участвуя не только в гемостазе, но и в процессах регенерации, ангиогенеза, воспаления, тромбоциты содержат более 300 биологически активных молекул, действующих в роли медиаторов и регуляторов. Альфа-гранулы, содержащиеся в тромбоцитах, являются резервуаром ряда важных факторов роста и цитокинов, высвобождение которых путем экзоцитоза, при активации тромбоцитов, стимулирует и регулирует регенерацию тканей [7, 10, 12, 25, 26, 28].
Факторы роста тромбоцитов, являясь по сути малыми полипептидами, характеризуются хемотаксическими и митогенными свойствами с возможностью модуляции клеточной пролиферации и функции, стимулируя таким образом регенерацию поврежденных мягких и твердых тканей [3, 5, 12]. Наиболее важными факторами роста, высвобождаемыми тромбоцитами, являются: фактор роста эндотелия сосудов (vascular endothelial growth factor – VEGF), трансформирующий фактор роста b (transforming growth factor-b – TGF-b), тромбоцитарный фактор роста (platelet-derived growth factor – PDGF), фактор роста фибробластов (fibroblast growth factor – FGF), эпидермальный фактор роста (epidermal growth factor – EGF), инсулиноподобные факторы роста 1 и 2 (insulin-like growth factors 1 and 2 – IGF-1 and IGF-2), матриксные металлопротеиназы 2 и 9, интерлейкин-8 [2, 27]. Связываясь со специфичными рецепторами на поверхности клеток-мишеней, они инициируют синтез белков, коллагена и остеоида [31].
Помимо этого, тромбоциты также высвобождают локально сигнальные молекулы, которые привлекают макрофаги [18]. По некоторым данным, БТП также участвует в неспецифическом иммунном ответе, благодаря содержанию малого количества лейкоцитов, способных синтезировать интерлейкины [37].
Благодаря содержанию в составе БТП трех белков крови – фибрина, фибронектина и витронектина, действующих как молекулы адгезии, тромбоцитарный концентрат способствует формированию костной ткани, в том числе посредством остеокондукции [30, 33].
Таким образом, основной целью применения концентратов тромбоцитов в клинической практике является активация миграции, пролиферации и дифференциация резервов клеток в области повреждения с целью оптимальной регенерации тканей, что имеет особое значение в местах повреждения с пониженным их содержанием [29].
Для приготовления БТП нами используются пробирки T-LAB PRP TUBE объемом 10 мл.
Критически значимым для успеха процедуры является структурная целостность тромбоцитов после центрифугирования, так как только неактивированные тромбоциты могут высвобождать факторы роста. Не менее 60% тромбоцитов должны оставаться жизнеспособными после центрифугирования.
Процент сохранности тромбоцитов зависит от скорости и продолжительности центрифугирования и от типа пробирки, используемой для получения PRP, в первую очередь от антикоагулянта. Антикоагулянт должен предотвращать преждевременную дегрануляцию тромбоцитов, не оказывая влияния на другие форменные элементы. Таким веществом является цитрат натрия. Именно он содержится в пробирках T-LAB PRP TUBE.
По результатам исследований, проведенных производителем, использование T-LAB PRP TUBE для получения богатой тромбоцитами плазмы позволяет получить более 68% сохранных (неактивированных) тромбоцитов.
Благодаря отсутствию разделительного геля в составе пробирки T-LAB PRP TUBE дают возможность применять различные протоколы центрифугирования и в результате получать тот тип плазмы (богатая тромбоцитами, богатая лейкоцитами, бедная лейкоцитами и т.д.), применение которой патогенетически оправдано. Пробирки T-LAB PRP TUBE успешно применяются в травматологии, хирургии, гинекологии, дерматологии, спортивной медицине и стоматологии.
На одну процедуру, непосредственно перед ее проведением, выполняют забор 10 мл венозной крови пациента в пробирку. Далее пробирки с венозной кровью центрифугируют в течение 4 минут со скоростью 2300 оборотов/минуту. В результате происходит разделение крови в пробирке на три слоя: верхний, содержащий тромбоциты, взвешенные в плазме; средний, содержащий лейкоциты (так называемая зона лейкоцитарной пленки); и нижний, представленный эритроцитами. Забор полученной чистой БТП средним объемом 2,5 мл, расположенной в верхнем слое пробирки, проводят длинной иглой (18G) на 5 мл шприце.
Важно отметить, что БТП необходимо готовить непосредственно перед процедурой, и использовать (вводить в ткани) в первые 10 минут после приготовления, поскольку высвобождение 95% факторов роста из тромбоцитов начинается спустя 10 минут и заканчивается спустя 1 час после активации продукта [13, 20, 32, 38].
Клинический случай
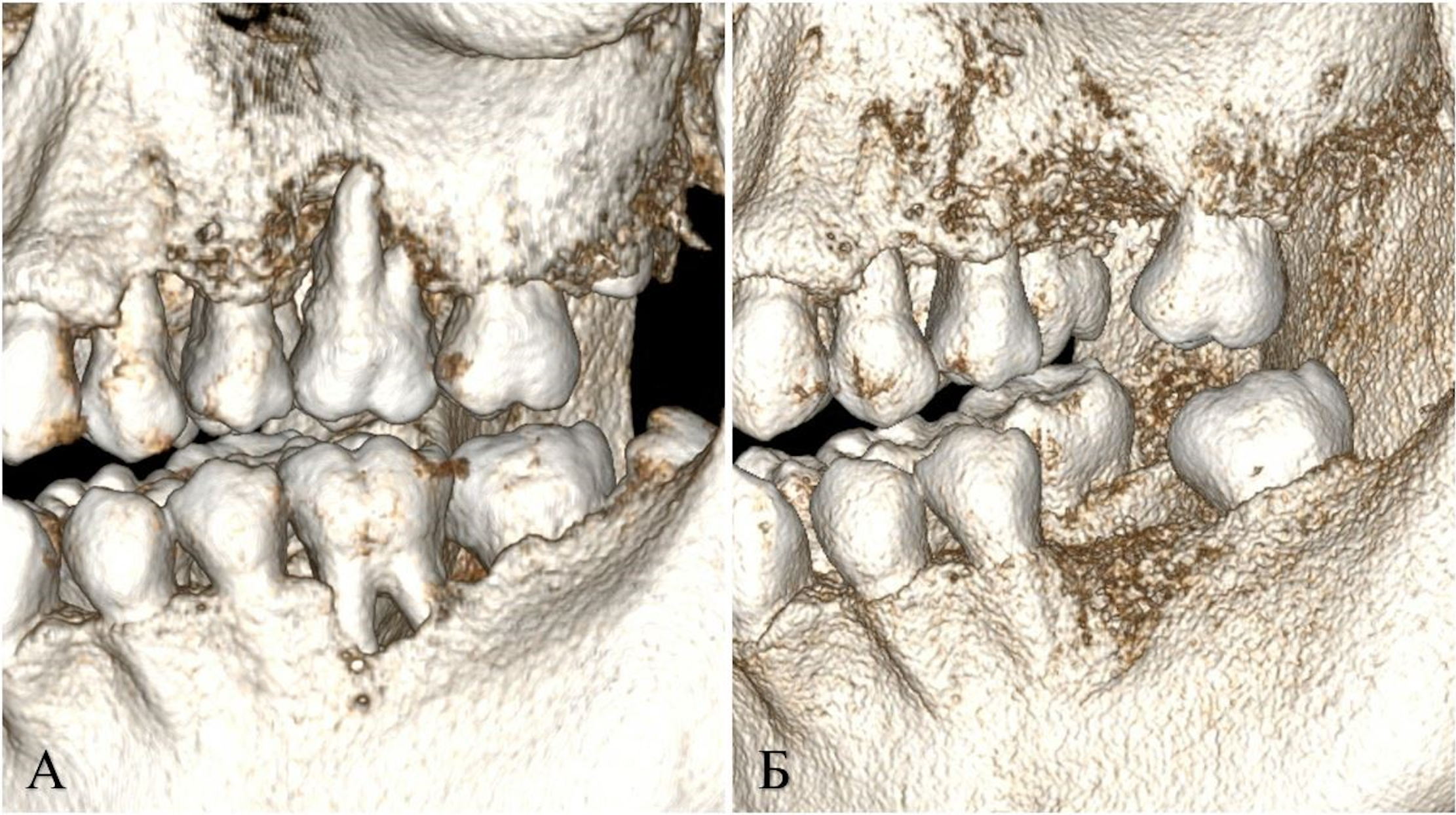
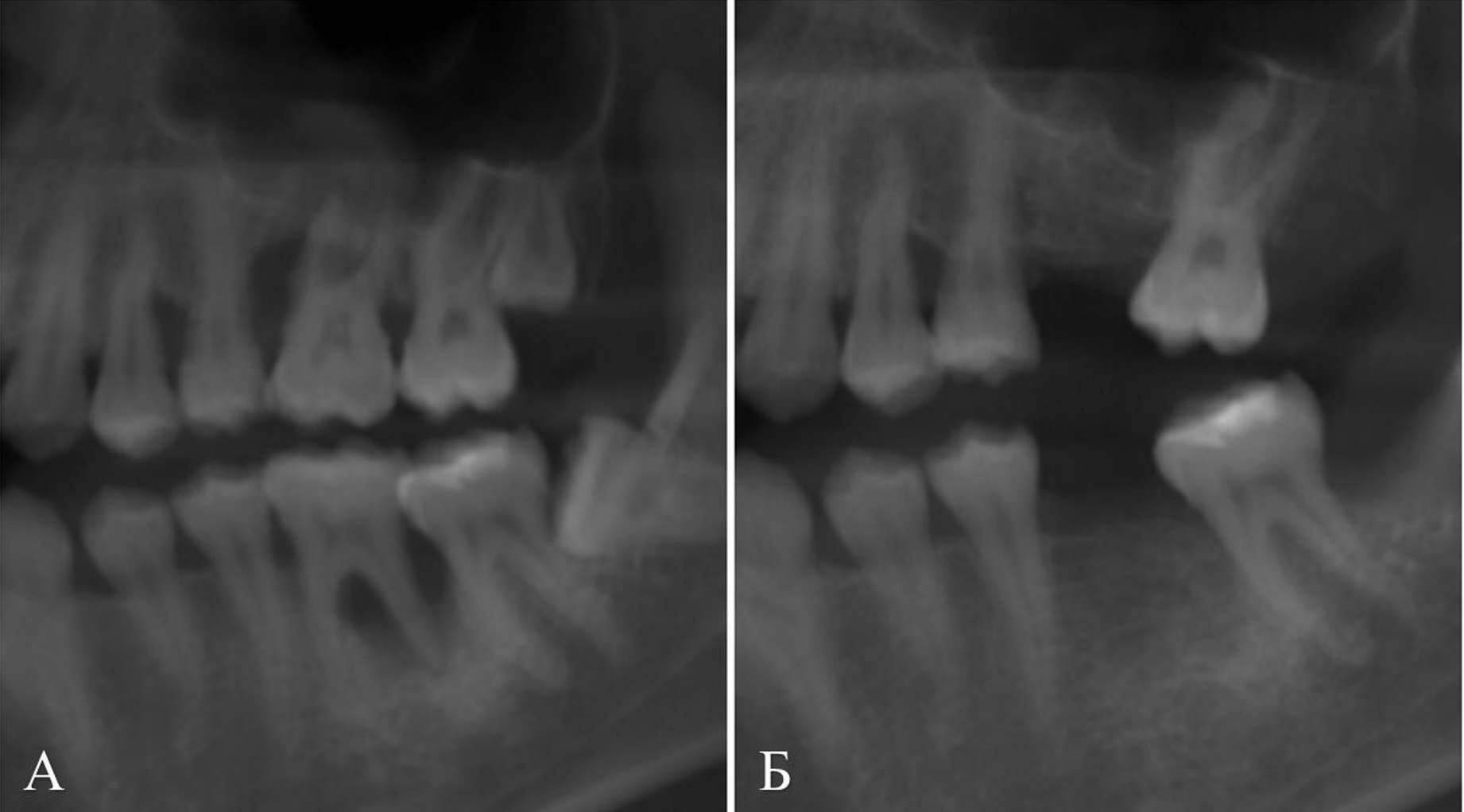
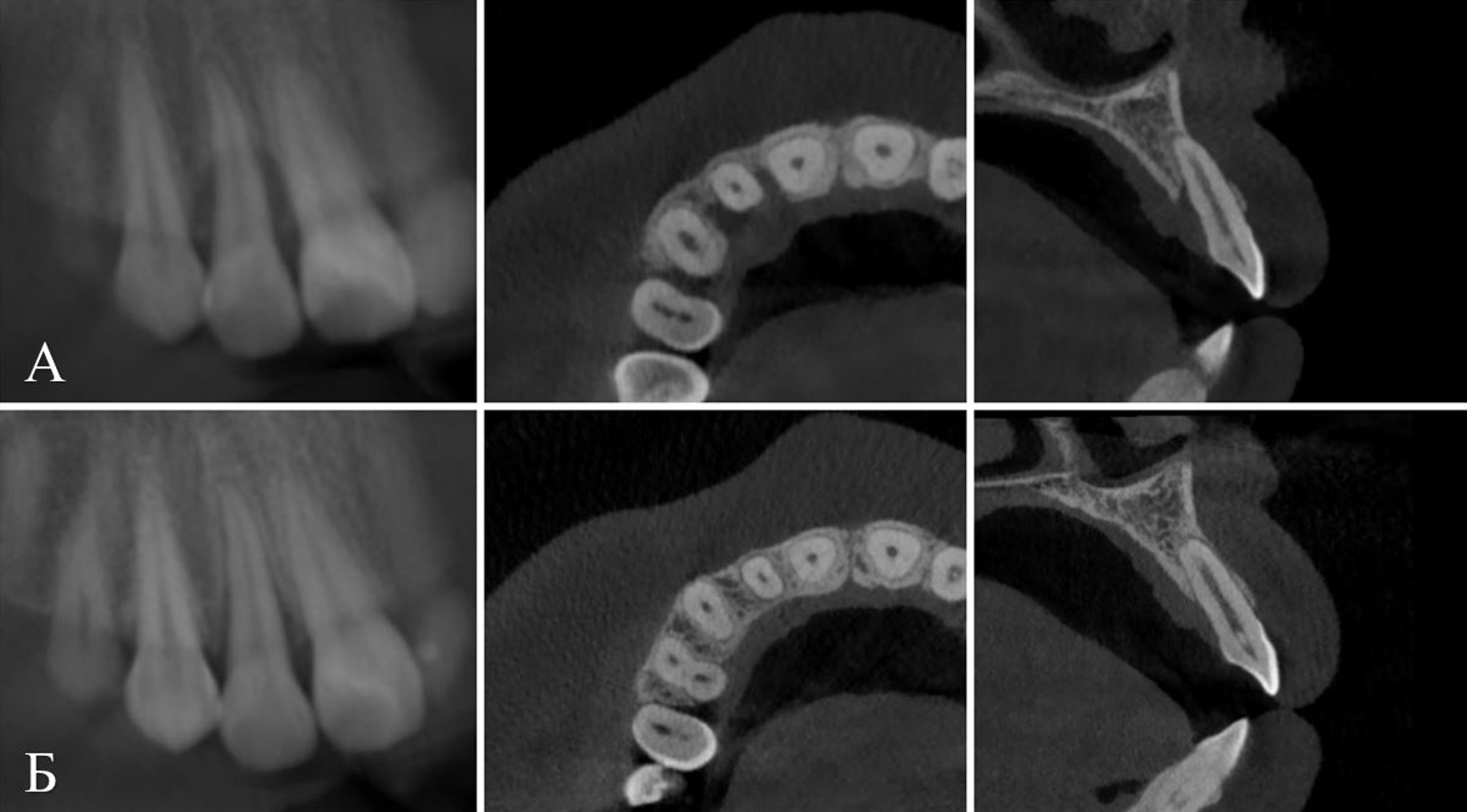
В клинику обратилась пациентка 20 лет с жалобами на подвижность зубов 26 и 36, периодические кровотечения из десен. При осмотре отмечена патологическая подвижность II степени зубов 26 и 36, гиперемия и отечность десны, прилегающей к ним. При пальпации по вестибулярной поверхности альвеолярной кости верхней и нижней челюстей отмечены серозные выделения из десневых карманов в области данных зубов. Рентгенологическое исследование (КЛКТ) челюстей выявило признаки локальной деструкции костной ткани вокруг корней зубов 26, 36 с распространением на область фуркаций и разрушением межкорневой перегородки (Рис 1, 2 – А). Также отмечена патологическая подвижность II степени зуба 12. Рентгенологически визуализирована деструкция корональной ½ альвеолярной кости вокруг зуба с резорбцией соответствующих мезиальной и дистальной межзубных перегородок (Рис. 3 – А). Помимо этого, был выявлен воспалительный процесс в виде пародонтальных карманов с выделением гнойного экссудата и специфическим запахом в различных областях полости рта.
С целью уточнения диагноза и причин воспаления в области пародонта пациентка была направлена на дополнительные обследования. Выполнена денситометрия, микробиологическое исследование выделений из пародонтальных карманов. Проведены консультации врачей: пародонтолога, аллерголога-иммунолога, эндокринолога, гематолога, челюстно-лицевого хирурга. Результаты исследований и обследований указывали на локальное воспаление. Выставлен диагноз: локализованный пародонтит.
Проведена профессиональная гигиена полости рта. Учитывая наличие воспалительного процесса и деструкции межкорневых перегородок зубов 26, 36, проведено их удаление с санацией лунок. С целью сохранения объема костной ткани в лунки удаленных зубов уложен ксеногенный костный материал, слизисто-надкостничные лоскуты в области удаленных зубов отмобилизованы и сопоставлены, раны ушиты наглухо. Терапия антибиотиками и укрепление общего иммунитета выраженного результата не дали.
Далее проведен курс плазмотерапии (PRP-терапии). Дополнительные медикаменты не назначались, рекомендована усиленная гигиена полости рта в домашних условиях. Биоматериал (БТП) готовили по вышеописанному протоколу. БТП вводили в мягкие ткани (слизистую оболочку) полости рта, по всему периметру зубных рядов, в проекции каждого межзубного сосочка и по переходной складке в проекции каждого зуба. На одну процедуру использовали одну пробирку. Всего за курс терапии проведено 8 процедур.
Уже после первых двух процедур введения БТП в мягкие ткани было выявлено локальное улучшение. После третьей процедуры отмечались значительные улучшения по всей полости рта. Исчезла кровоточивость, десны стали крепче, исчезли неприятный специфический запах и выделения из десневых карманов, патологическая подвижность зубов.
При контрольном осмотре, спустя 4 месяца после проведенного лечения, на КЛКТ челюстей отмечено восстановление костной ткани в области удаленных зубов 26 и 36 (Рис. 1, 2 – Б), восстановление костной ткани в области зуба 12 – межзубных мезиальной и дистальной перегородок, а также небной кортикальной пластинки (Рис. 3 – Б).
Заболевания пародонта являются наиболее частыми хроническими поражениями опорных тканей зуба, начинающиеся, как правило, с поверхностных воспалительных процессов в десне (гингивит) и прогрессирующие до потери прикрепления зубо-десневого комплекса с последующей деструкцией альвеолярной кости (пародонтит) [6, 17].
Восстановление опорных структур зуба, разрушенных вследствие пародонтальной болезни, является основной целью лечения [14, 33]. Пародонтальная хирургия направлена на восстановление альвеолярной кости, цемента корня и периодонтальной связки [8].
Терапия БТП призвана увеличить предсказуемость лечебных мероприятий, направленных на регенерацию пародонта. Локальное высвобождение факторов роста активированными тромбоцитами оказывает, посредством клеточных сигналов, регулирующее воздействие на гомеостаз тканей пародонта и изменяет ответ мягких и твердых тканей пародонта с целью улучшения результатов восстановления и заживления [11, 39].
Успешность и надежность применения тромбоцитарных концентратов, среди которых и БТП, при устранении костных дефектов челюстей была доказана рядом исследований [24] и подтверждены практическим опытом.
Вывод:
Несмотря на то, что в стоматологии PRP-терапия используется сравнительно недавно, она приобрела широкую популярность и успела зарекомендовать себя как безопасная и результативная процедура.
Простота применения аутологичной плазмы, доступная стоимость расходных компонентов и возможность сочетания с другими методами лечения, в том числе медикаментозными и хирургическими, позволяет включать ее в базовые схемы ведения пациентов с целью усиления эффекта от таргетных процедур, направленных на устранение основной проблемы.
Плазмотерапия имеет широкий спектр применения в стоматологической практике. Ее использование патогенетически оправданно не только в пародонтологии, но и в общей терапии, ортопедии, имплантологии и хирургии.
Процедура введения плазмы является малоинвазивной и комфортно переносится пациентами, а главное, позволяет сократить реабилитационный период даже при серьезных вмешательствах в зубочелюстную систему, что немаловажно, в том числе и для формирования доверительных отношений между врачом и пациентом.
И, исходя из собственного опыта, можно порекомендовать введение аутологичной плазмы в качестве профилактики на ранних стадиях заболеваний ротовой полости для купирования воспалительных процессов, устранения кровоточивости десен и улучшения обменных процессов в тканях, что дает возможность избежать перехода проблем в стадию, требующую применения хирургических методов, а также сохранить зубной ряд и естественную улыбку пациента.
- Albanese A., Licata M.E., Polizzi B., Campisi G. Platelet-rich plasma (PRP) in dental and oral surgery: from the wound healing to bone regeneration. Immunity & ageing. 2013; 10:23.
- Andia I., Abate M. Platelet-rich plasma: underlying biology and clinical correlates. Regenerative medicine. 2013;8:645-658.
- Anitua E., Sanchez M., Orive G., et al. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 2007;28:4551-4560.
- Anitua E., Tejero R., Zalduendo M.M., Orive G. Plasma rich in growth factors promotes bone tissue regeneration by stimulating proliferation, migration, and autocrine secretion in primary human osteoblasts. J Periodontol. 2013;84:1180-1190.
- Borzini P., Mazzucco L. Platelet gels and releasates. Curr Opin Hematol. 2005;12:473-479.
- Bosshardt D.D., Sculean A. Does periodontal tissue regeneration really work? Periodontology. 2009;2000(51):208-219.
- Broos K., De Meyer F., Feys B., et al. Blood platelet biochemistry. Thromb Res. 2012;129:245-249.
- Camargo P.M., Lekovic V., Weinlaender M., Vasilic N., Madzarevic M., Kenney E.B. Platelet-rich plasma and bovine porous bone mineral combined with guided tissue regeneration in the treatment of intrabony defects in humans. Journal of periodontal research. 2002;37:300-306.
- Chou T.-M., Chang H.-P., Wang J.-C. Autologous platelet concentrates in maxillofacial regenerative therapy. Kaohsiung J Med Sci. 2020;1-6.
- De Lima J., Carmo K.B. Practical pain management in the neonate. Best practice & research Clinical anaesthesiology. 2010;24:291-307.
- Dereka X.E., Markopoulou C.E., Vrotsos I.A. Role of growth factors on periodontal repair. Growth Factors. 2006; 24:260-267.
- Everts A., Knape T., Weibrich G., et al. Platelet-rich plasma and platelet gel: a review. J Extra Corpor Technol. 2006;38:174-187.
- Feigin K., Shope B. Use of Platelet-Rich Plasma and Platelet-Rich Fibrin in Dentistry and Oral Surgery: Introduction and Review of the Literature. Journal of veterinary dentistry. 2019;36:109-123.
- Forni F., Marzagalli M., Tesei P., Grassi A. Platelet gel: applications in dental regenerative surgery. Blood transfusion = Trasfusione del sangue. 2013;11:102-107.
- Han J., Meng H.X., Tang J.M., Li S.L., Tang Y., Chen Z.B. The effect of different platelet-rich plasma concentrations on proliferation and differentiation of human periodontal ligament cells in vitro. Cell Prolif. 2007;40:241-252.
- Huang Y., Bornstein M.M., Lambrichts I., Yu H.Y., Politis C., Jacobs R. Platelet-rich plasma for regeneration of neural feedback pathways around dental implants: a concise review and outlook on future possibilities. International journal of oral science. 2017;9:1-9.
- Laugisch O., Cosgarea R., Nikou G., Nikolidakis D., Donos N., Salvi G.E., Stavropoulos A., Jepsen S., Sculean A. Histologic evidence of periodontal regeneration in furcation defects: a systematic review. Clinical oral investigations. 2019;23:2861-2906.
- Lindeboom J.A., Mathura K.R., Aartman I.H., et al. Influence of the application of platelet-enriched plasma in oral mucosal wound healing. Clin Oral Implants Res. 2007;18:133-139.
- Lynch S.E. Effect of the platelet-derived growth factor/insulin-like growth factor-1 combination on bone regeneration around titanium dental implants. Results of a pilot study in beagle dogs. J Periodontol. 1991;62:710-716.
- Marx R.E., Carlson E.R., Eichstaedt R., et al. Platelet-rich plasma: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85:638-646.
- Marx R.E. Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant dentistry. 2001;10:225-228.
- Marx R.E. Platelet-rich plasma: evidence to support its use. Journal of Oral Maxillofacial Surgery. 2004;62:489-496.
- Meschi N., Castro A.B., Vandamme K., Quirynen M., Lambrechts P. The impact of autologous platelet concentrates on endodontic healing: a systematic review. Platelets. 2016;27:613-633.
- Miron R.J., Zucchelli G., Pikos M.A., Salama M., Lee S., Guillemette V., Fujioka-Kobayashi M., Bishara M., Zhang Y., Wang H.L., Chandad F., Nacopoulos C., Simonpieri A., Aalam A.A., Felice P., Sammartino G., Ghanaati S., Hernandez M.A., Choukroun J. Use of platelet-rich fibrin in regenerative dentistry: a systematic review. Clinical oral investigations. 2017;21:1913-1927.
- Nurden A.T., Nurden P., Sanchez M., Andia I., Anitua E. Platelets and wound healing. Frontiers in bioscience: a journal and virtual library. 2008;13:3532-3548.
- Nurden A.T. Platelets, inflammation and tissue regeneration. Thrombosis and haemostasis. 2011;105 Suppl 1:S13-33.
- Rodriguez I.A., Growney Kalaf E.A., Bowlin G.L., Sell S.A. Platelet-rich plasma in bone regeneration: engineering the delivery for improved clinical efficacy. BioMed research international. 2014;2014:392-398.
- Rozman P., Bolta Z. Use of platelet growth factors in treating wounds and soft-tissue injuries. Acta Dermatovenerol Alp Pannonica Adriat. 2007;16:156-165.
- Sammartino G., Tia M., Marenzi G., et al. Use of autologous platelet-rich plasma (PRP) in periodontal defect treatment after extraction of impacted mandibular third molars. J Oral Maxillofac Surg. 2005;63:766-770.
- Sanchez A.R., Sheridan, P.J., Kupp, L.I. Is platelet-rich plasma the perfect enhancement factor? A current review. International Journal of Oral Maxillofaial Implants. 2003;18: 93-103.
- Schliephake H. Bone growth factors in maxillofacial skeletal reconstruction. Int J Oral Maxillofac Surg. 2002;31:469-484.
- Somani R., Zaidi I., Jaidka S. Platelet-rich plasma – a healing aid and perfect enhancement factor: review and case report. Int J Clin Pediatr Dent. 2011;4:69-75.
- Tozum T.F., Demiralp B. Platelet-rich plasma: a promising innovation in dentistry. J Can Dent Assoc. 2003;69:664.
- Wang K.H., Inman J.C., Hayden R.E. Modern conceptsin mandibular reconstruction in oral and oropharyngeal cancer. Curr Opin Otolaryngol Head Neck Surg. 2011;19:119-124.
- Weibrich G., Kleis W.K., Hafner G., et al. Growth factor levels in plateletrich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 2002;30:97-102.
- Whitman D.H., Berry R.L., Green D.M. Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. Journal of oral and maxillofacial surgery: official journal of the American Association of Oral and Maxillofacial Surgeons. 1997;55:1294-1299.
- Wrotniak M., Bielecki T., Gazdzik T.S. Current opinion about using the platelet-rich gel in orthopaedics and trauma surgery. Ortop Traumatol Rehabil. 2007;9:227-238.
- Wu C.L., Lee S.S., Tsai C.H., Lu K.H., Zhao J.H., Chang Y.C. Platelet-rich fibrin increases cell attachment, proliferation and collagen-related protein expression of human osteoblasts. Australian dental journal. 2012;57:207-212.
- Yamada Y., Ueda M., Hibi H., Baba S. A novel approach to periodontal tissue regeneration with mesenchymal stem cells and platelet-rich plasma using tissue engineering technology: A clinical case report. The International journal of periodontics & restorative dentistry. 2006;26:363-369.