Особенности строения слизистой оболочки полости рта у пожилых лиц при некоторых формах висцеральной патологии
С. И. Токмакова
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии Алтайского государственного медицинского университета (Барнаул)
О. В. Бондаренко
к. м. н., доцент кафедры терапевтической стоматологии Алтайского государственного медицинского университета (Барнаул)
О. В. Сысоева
к. м. н., доцент кафедры терапевтической стоматологии Алтайского государственного медицинского университета (Барнаул)
Актуальность проблемы
Физиологические процессы и наличие системных заболеваний организма, по мнению ряда авторов [3, 6], существенно влияют на состояние органов полости рта. Старение, не являясь болезнью, создает предпосылки для развития возрастной патологии. Среди хронических болезней особенно часто встречаются заболевания сосудов и сердца, центральной нервной системы, желудочно-кишечного тракта, диабет и онкологические заболевания [3, 9].
Есть основание полагать [1, 5, 10, 12], что слизистая оболочка полости рта (СОПР), являясь сложной многофункциональной системой, даже до периода появления патологических элементов может служить показателем общего здоровья организма. Однако исследования, посвященные этой проблеме, немногочисленны и касались в основном ее изменений при различных заболеваниях [4, 6].
Цель исследования
Оценка изменений СОПР на светооптическом и ультраструктурном уровнях при некоторых формах висцеральной патологии с учетом возрастного фактора.
Материал и методы
В ходе работы были обследованы пациенты-добровольцы старше 60 лет с заболеваниями сердечно-сосудистой системы (ССС) — 10 человек, язвенной болезнью желудка и двенадцатиперстной кишки — 10 человек — и сахарным диабетом (СД) — 10 человек. Контрольную группу составили относительно здоровые пожилые без видимой патологии слизистой оболочки полости рта.
Для изучения морфологии СОПР были использованы гистологическое и электронно-микроскопическое исследования участков СОПР, где наиболее часто возникают процессы, связанные с патологическим ороговением: нижняя губа в зоне Клейна, щека на уровне смыкания зубов, граница твердого и мягкого неба, боковая поверхность языка.
Светооптическое исследование микробиоптатов размером 2х2 мм и соскобов проводилось на микроскопе Jenaval (Carl Zeiss, Jena, Германия) при увеличении х250—400 с использованием полутонких срезов (0,4—1 мкм), окрашенных 1%-ным раствором азура II; электронномикроскопическое исследование ультратонких срезов, последовательно контрастированных уранилацетатом и цитратом свинца, под электронным микроскопом Hitachi-600 (Япония) при увеличении х3500—30 000.
Результаты и обсуждение
В биоптатах с неороговевающих участков СОПР (губа и щека) относительно здоровых пожилых лиц светооптическое исследование выявило наличие достаточно выраженного поверхностного слоя (до 6—10 слоев). В эпителиоцитах поверхностного слоя находились пикнотично измененные ядра, гранулы кератогиалина (рис. 1).
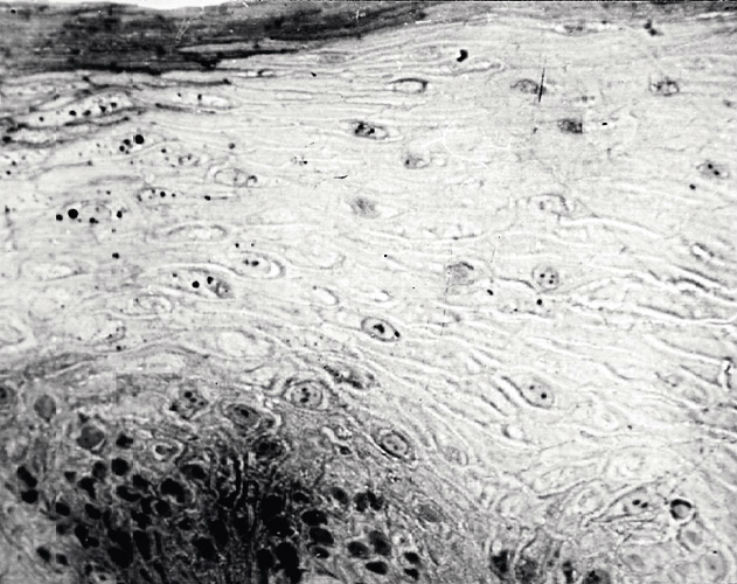
Рис. 1. Биоптат слизистой оболочки губы. Гипохромная окраска клеток поверхностного слоя, гранулы кератогиалина в эпителиоцитах зернистого слоя. Полутонкий срез. Азур II. Ув. х250.
Встречались неравномерно расширенные перинуклеарные пространства.
При ультраструктурном исследовании у лиц контрольной группы определялось нарушение межклеточных контактов с образованием оптически прозрачных участков между клетками с фрагментами цитоплазматических отростков соседних клеток. Единичные митохондрии имели признаки деструкции. Межклеточные соединения имели вид замковых креплений, но по направлению к апикальной поверхности контуры мембраны сглаживались, уменьшалось количество зубчатых соединений и десмосом.
На апикальной поверхности биоптатов определялось несколько слоев кератиноцитов с повышенной осмиофильностью цитоплазмы. Поверхностные клетки отличались более крупными размерами, меньшим количеством тонофиламентов в цитоплазме.
В шиповатом слое эпителиоциты были связаны друг с другом зубчато-волнообразными соединениями (рис. 2).
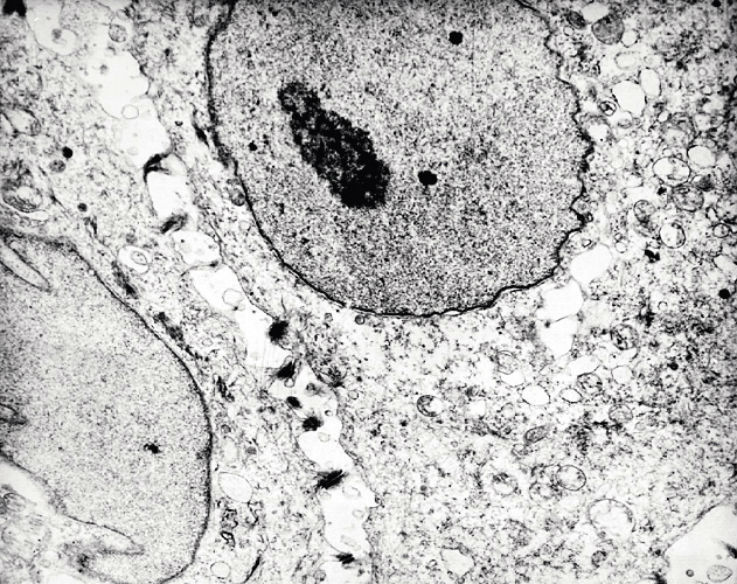
Рис. 2. Биоптат слизистой оболочки щеки. Шиповатый слой. Межклеточные контакты типа десмосом. Полиморфизм ядер. Электронограмма. Ув. х 6000.
Межклеточные расстояния расширялись неравномерно ближе к поверхностному слою. В цитоплазме шиповатых клеток крупные пучки тонофиламентов ориентировались в сторону периферических отделов цитоплазмы и к зоне клеточных контактов. Рибосомы и митохондрии концентрировались преимущественно в центральной и околоядерной зонах, было характерно наличие крупных кератогиалиновых гранул. Цитоплазма вакуолизировалась, встречались достаточно крупные вакуоли, смещавшие ядро к цитоплазматической мембране. На границе шиповатого и базального слоев встречались единичные клетки Лангерганса.
В базальном слое цилиндрические клетки располагались равномерно вдоль базальной мембраны, межклеточные промежутки не определялись. Митотически делящиеся клетки группировались преимущественно на дне эпителиальных гребешков. Количество митозов достигало 1—2 на 50—100 клеток.
Межклеточные контакты сохранялись в виде десмосом и полудесмосом. Цитоплазматические органеллы имели хаотичное расположение, однако прослеживалась перинуклеарная их концентрация. Филаменты были структурно связаны с рибосомами, реже с наружными мембранами митохондрий, что отражало активные процессы синтеза фибриллярного белка. Встречались единичные мигрирующие трансэпителиально лейкоциты.
Базальная мембрана при светооптическом исследовании представляла собой тонкую непрерывную линию, равномерно окрашивающуюся азуром, в ее составе различались электронно-прозрачная и электронно-плотная части.
В собственной пластинке слизистой оболочки выделялись сосочковый и сетчатый слои. В биоптатах губы и щеки собственная пластинка образовывала многочисленные сосочки, внедрявшиеся в эпителий, содержавшие тонкостенные сосуды. В случае атрофии собственная пластинка слизистой оболочки выглядела отечной, прослеживалась интенсивная лейкоцитарная инфильтрация, количество коллагена повышалось, толщина стенок сосудов увеличивалась.
В слизистой оболочке языка сохранялась региональная гистоархитектоника, соотношение слоев не нарушалось. Дифференцировались роговой, зернистый, шиповатый и базальный слои. В биоптатах определялся умеренно выраженный роговой слой, на поверхности эпителия скапливалась микрофлора.
Исследование соскоба на ороговевающем эпителии (граница твердого и мягкого неба) позволило изучить структурные особенности жевательного типа слизистой оболочки полости рта. В соскобе дифференцировались темные и светлые кератиноциты (рис. 3).
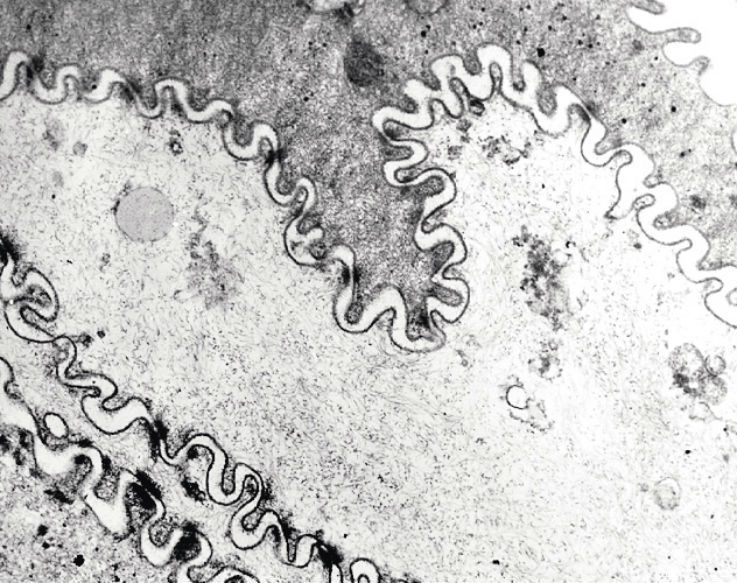
Рис. 3. Соскоб со слизистой оболочки твердого неба. Клеточный комплекс, состоящий из светлых и темных кератиноцитов. Электронограмма. Ув. х 12000.
Как правило, преобладали узкие осмиофильные клетки (темные), отражавшие свойственный твердому небу процесс интенсивного ороговения. Они характеризовались плотной упаковкой толстых пучков тонофиламентов, погруженных в аморфный материал. В темных клетках фибриллярный материал располагался компактно, лежал на фоне мелкогранулярного матрикса.
На поверхности клеток встречалась кокковая микрофлора. В светлых ядросодержащих клетках цитоплазма заполнялась рыхло расположенным тонофибриллярным материалом, среди которого просматривались редкие мелкие цистерны эндоплазматической сети, липидные капли, митохондрии с лизированным матриксом и кристами и небольшие скопления мелкогранулярного материала (рибосомы). Отмечалась незначительная адгезия однотипной кокковой микрофлоры на поверхности темных кератиноцитов.
У пациентов с различными формами соматических заболеваний наблюдалось изменение характера ороговения: с одной стороны, развивался гиперкератоз в неспецифических участках (губа, щека), носивший, как правило, защитный характер, с другой стороны, появлялись признаки атрофии и уменьшение рогового слоя в области твердого неба и на боковой поверхности языка. Нарушение гистоархитектоники слизистой оболочки при гиперкератозе свидетельствовало о нарушениях процессов дифференцировки, а при развитии атрофии — процесса десквамации эпителия.
Наряду с этим у пациентов исследуемых групп в цитоплазме клеток поверхностного и рогового слоя увеличивалось количество светооптически идентифицируемого кератогиалина в виде гранул по сравнению с контролем. Это указывало на нарушение экзоцитоза, обеспечивающего барьерную функцию эпителия. В клетках же зернистого и шиповатого слоев, особенно при заболеваниях ЖКТ, кератогиалин практически отсутствовал, что отмечалось в литературе и ранее [10].
Ультраструктурной особенностью висцеральной патологии на уровне шиповатых эпителиоцитов являлось изменение структуры тонофиламентов, нарушение их четкой ориентации, фрагментации фибриллярного материала. Как следствие, во всех основных группах отмечалось расширение межклеточных расстояний (рис. 4) и нарушение межклеточных контактов (82±5,8 % наблюдений), расцененное как акантолиз.
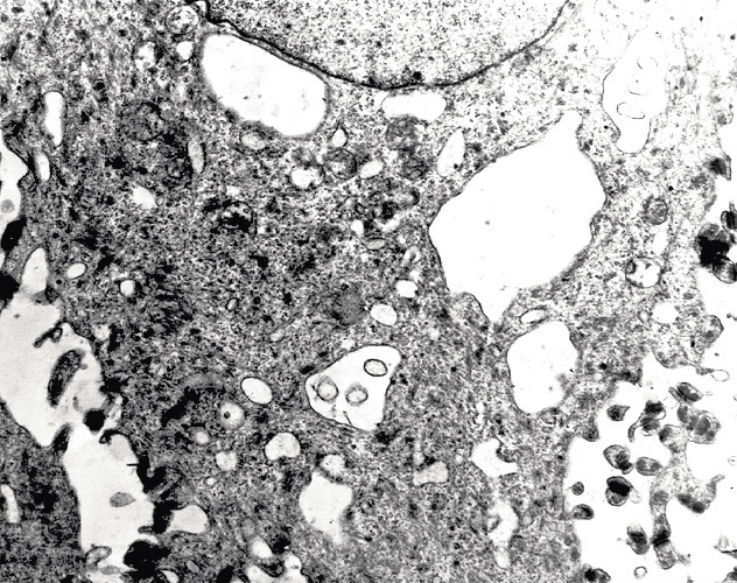
Рис. 4. Биоптат слизистой оболочки губы. Шиповатый слой. Вакуолизация цитоплазмы, расширение межклеточных расстояний. Электронограмма. Ув. х 6000.
В расширенных межклеточных пространствах определялись изолированные десмосомы, фрагменты цитоплазматических отростков и органелл. Декомпенсацию барьерно-защитной функции можно связать с уменьшением количества гликозаминогликанов в межклеточных промежутках, поскольку содержание гликогена в полиэдрических клетках было достоверно ниже.
На фоне соматических заболеваний, особенно сахарного диабета, изменялись тинкториальные свойства клеток шиповидного слоя. В препаратах дифференцировались три фенотипически различных типа клеток по отношению к окраске азуром — светлые, темные и промежуточные. Светлые клетки, отнесенные к паракератозным, чаще всего располагались группами, Темные — узкие и длинные с осмиофильной цитоплазмой за счет хаотично расположенных толстых пучков тонофиламентов — лежали разрозненно.
Превалирование светлых и промежуточных форм в препаратах твердого неба у пациентов с висцеральными заболеваниями свидетельствовало о нарушении гистоархитектоники эпителия. Кроме того, наблюдались различия в микробной колонизации темных и светлых клеток (рис. 5).
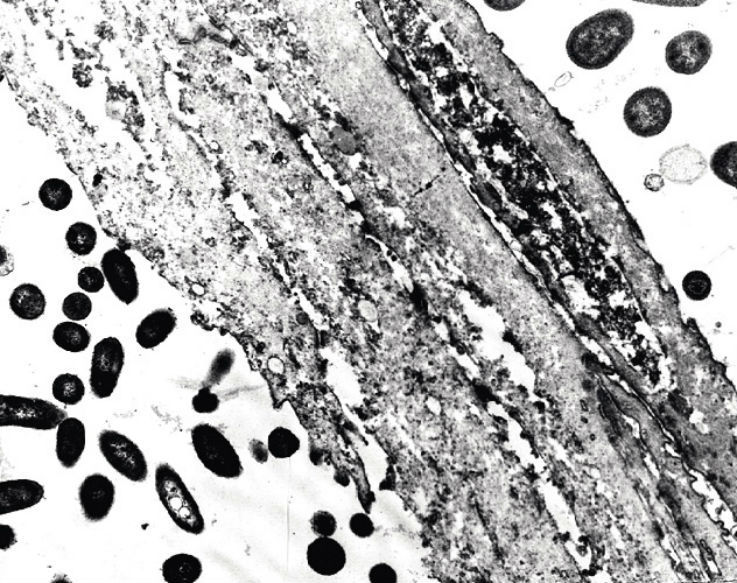
Рис. 5. Соскоб со слизистой оболочки твердого неба. Скопление светлых кератиноцитов окружено бациллярной микрофлорой. Электронограмма. Ув. х 6000.
Подобное фенотипическое разделение эпителиоцитов, а не процессы дифференцировки, как утверждают некоторые авторы [2, 4], по нашему мнению, объясняет неравномерность их микробной обсемененности. Важно отметить, что микроорганизмы не проникали в цитоплазму эпителиоцитов, а располагались вдоль мембраны. Исключение составляли внутриклеточные инфекции, в частности, хламидии, элементарные и ретикулярные тельца которых встречались в единичных наблюдениях. В связи с этим можно предположить, что СОПР является областью внедрения микроорганизмов только при нарушении ее целостности или инвазии специфических инфекций.
Редкая фиксация митозов (1 на 200 клеток) или их отсутствие в базальных эпителиоцитах у лиц с висцеральной патологией отражали нарушение процесса регенерации. Это согласуется с данными об уменьшении митотического индекса у пожилых [6]. Показателем снижения пролиферативной активности эпителия у пожилых с заболеваниями внутренних органов являлось электронномикроскопически определяемое уменьшение количества пиноцитозных пузырьков и увеличение по сравнению с молодыми числа тонофиламентов в эпителиоцитах, а закономерным исходом ее — развитие атрофических процессов.
На снижение барьерной функции эпителия указывали патологические изменения базальной мембраны, заключавшиеся в ее утолщении, прерывистости и разрыхлении, а также нарушения в собственной пластинке СОПР, для которой было характерно увеличение количества коллагеновых волокон, уменьшение высоты эпителиальных сосочков. Утолщение стенок сосудов, выраженное особенно у пациентов с заболеваниями ССС, отражало течение системного патологического процесса.
Склеротические изменения соединительной ткани и базальной мембраны и относительная редукция капиллярного русла собственной пластинки СОПР снижали транспорт электролитов и компонентов плазмы в эпителий и являлись прямой причиной развивающихся в нем дистрофических изменений.
Некоторые морфологические признаки (редкое появление полиморфноядерных нейтрофильных лейкоцитов и клеток Лангерганса в материале соскобов и микробиоптатах, отсутствие функционально активных сегментоядерных нейтрофилов и лимфоцитов) косвенно указывали на снижение защитных механизмов слизистой оболочки.
Чрезвычайно редко наблюдались деструктурированные нейтрофилы, что подтверждает полученные ранее данные [4] при исследовании здоровой СОПР. Следует отметить снижение интенсивности трансэпителиального диапедеза лимфоцитов, что в целом отражало общее снижение активности иммунокомпетентных клеток, связанное как с течением сочетанных хронических соматических заболеваний, так и с возрастом пациентов. Указанные явления имели место и в собственной пластинке СОПР.
Заключение
В целом при проведении светооптического и электронно-микроскопического исследования биоптатов слизистой оболочки полости рта у пожилых лиц, не имевших соматической патологии, выявлено нарушение гистоархитектоники выстилающего эпителия (гиперкератоз), умеренно выраженный акантолиз и дистрофические изменения эпителиоцитов поверхностного и шиповатого слоев, уменьшение или отсутствие клеток Лангерганса, что можно расценить как возрастные особенности строения СОПР. В то же время отмечено сохранение митотической активности базального эпителия и трансэпителиальной миграции мононуклеаров.
Анализируя образцы слизистой оболочки полости рта у пациентов с различными соматическими заболеваниями, следует отметить изменение основных тканевых и клеточных механизмов защиты слизистой оболочки. В частности, нарушались физиологические барьеры (атрофия, гиперкератоз, формирование внутриэпителиальных пузырей), снижался уровень неспецифических гуморальных факторов (дистрофия эпителия, уменьшение числа клеток Лангерганса) и клеточных механизмов (отсутствие гранулоцитов, снижение уровня трансэпителиального диапедеза).
Список литературы находится в редакции