Постимплантационное ведение пациентов с дентальными имплантатами при наличии сопутствующей патологии пародонта
Р. Т. Буляков
д. м. н., доцент, заведующий кафедрой стоматологии общей практики ИПО БГМУ, главный внештатный стоматолог Министерства здравоохранения Республики Башкортостан, заслуженный врач Республики Башкортостан, главный врач АУЗ «Республиканская стоматологическая поликлиника» (Уфа)
О. А. Гуляева
к. м. н., ассистент кафедры стоматологии общей практики ИПО БГМУ, врач- пародонтолог АУЗ «РСП» (Уфа)
Д. Н. Тухватуллина
к. м. н., доцент кафедры стоматологии общей практики ИПО БГМУ, заместитель главврача по лечебной части АУЗ «РСП» (Уфа)
Р. И. Сабитова
врач-стоматолог АУЗ «РСП» (Уфа)
В настоящее время дентальная имплантация занимает одно из ведущих мест в комплексе реабилитации пациентов с полным или частичным отсутствием зубов [2]. В России имплантология стала развиваться сравнительно недавно, но оказалась крайне востребованной областью стоматологии. Сегодня практически каждая клиника (частная и государственная) предлагает данный вид стоматологической помощи, так как имплантация является незаменимой альтернативой во многих клинических ситуациях.
Анализ рынка стоматологических услуг свидетельствует о том, что ежегодно в мире устанавливается более 2 млн имплантатов, уже в 90-е годы прошлого столетия общее число таких пациентов достигло 30 миллионов человек. Количество устанавливаемых имплантатов с каждым годом растет во всех экономически развитых странах. В США, например, за последние 20 лет произошло увеличение этого показателя в 10 раз [5].
Научные наблюдения и исследования клиницистов демонстрируют хорошие результаты имплантации, позволяющей достичь полноценного восстановления жевательной эффективности, речеобразования и эстетики зубного ряда. Несмотря на то что имплантация в последние годы отличается высоким уровнем успеха в раннем послеоперационном периоде, в научной литературе появляется все больше сведений о риске отдаленных осложнений.
Ежегодно в мире устанавливается более двух миллионов имплантатов, уже в 1990-е годы прошлого столетия общее число таких пациентов достигло 30 миллионов человек
Воспаление тканей, окружающих остеоинтегрированный имплантат, является одной из основных проблем имплантологии [6, 7]. Исследования последних лет свидетельствуют о том, что от 50 до 70 % пациентов с дентальными имплантатами страдают заболеваниями пародонта, что в отдаленном послеоперационном периоде может являться причиной потери зубов и имплантатов. Поэтому пациенты с ортопедическими конструкциями на дентальных имплантатах нуждаются в регулярном наблюдении не только хирурга-имплантолога, но и пародонтолога для предотвращения развития таких нежелательных воспалительных осложнений, как периимплатационный мукозит и периимплантит [3]. Дифференциальная диагностика между этими патологическими процессами осуществляется на основе клинических и рентгенологических исследований.
Мукозит в области имплантата — это воспаление окружающей слизистой оболочки в области шейки имплантата, выражающееся явлениями отека и гиперемии, высокой контактной кровоточивостью при зондировании периимплантатных карманов, без нарушения остеоинтеграции.
Согласно определению, данному в 1993 г. Европейской федерацией пародонтологов, периимплантит — это прогрессирующая резорбция окружающей имплантат костной ткани, вызванная воспалительным процессом в мягких тканях (слизистой оболочке), окружающих имплантат, сопровождающаяся образованием костных карманов и замещением резорбированных участков грануляционной тканью в зоне воспаления [9]. Диагноз периимплантита устанавливают на основании рентгенологически выявленных изменений кости в виде кратерообразной деструкции в окружности шейки и даже верхней трети имплантата.
Современные данные свидетельствуют о том, что мукозит может возникать у 60—80 % лиц, имеющих дентальные имплантаты, а развитие периимплантита описано у 10—56 % обследованных лиц [3, 13]. В нашей клинической практике подобные явления встречаются с частотой, соответствующей большинству данных научной литературы.
Патологические изменения вокруг имплантатов могут возникать как в ближайшие сроки после протезирования, так и по прошествии нескольких месяцев и даже лет. Основными факторами развития осложнений в ближайшем послеоперационном периоде могут являться ошибки при выполнении хирургических процедур и проведении протезирования, тогда как основной причиной развития воспалительного процесса периимплантатных тканей в отдаленном послеоперационном периоде является несоблюдение пациентом графика регулярных посещений пародонтолога (гигиениста) или их отсутствие.
Главными факторами риска в развитии периимплантита являются отсутствие рациональной регулярной гигиены естественных зубов и ортопедических конструкций в полости рта и наличие в анамнезе пародонтита. Имеется достаточно свидетельств, подтверждающих связь между повышенным риском развития периимплантита и воспалительными заболеваниями пародонта [11].
Многочисленные микробиологические исследования демонстрируют, что функционирование имплантатов сопровождается развитием биопленок на внекостных поверхностях имплантата и протеза, а микробиота этой поддесневой биопленки сходна с таковой в пародонтальных карманах при пародонтите [3], при этом биопленка в трансмукозной (пришеечной) области супраконструкций имплантатов способна вызывать хроническое продуктивное воспаление в периимплантатных тканях и привести к периимплантационному мукозиту и периимплантиту [4]. Развившийся периимплантит, клиническая и микробиологическая картина которого сравнима с таковой при пародонтите, приводит к сокращению срока службы всей имплантационной конструкции.
Мукозит может возникать у 60—80 процентов лиц, имеющих дентальные имплантаты, а развитие периимплантита описано у 10—56 процентов обследованных лиц
Ключевая роль в развитии периимплантита принадлежит микрофлоре биопленки, представляющей собой сообщество микроорганизмов, сгруппированных в микроколонии, защищенных вырабатываемым ими адгезивным матриксом. Причинно-следственная связь между накоплением микробной биопленки и развитием воспаления в тканях, окружающих имплантат, подтверждена в экспериментальных и клинических исследованиях [8]. Подтверждена даже возможность инфицирования тканей в области имплантата путем заноса периодонтопатогенной инфекции из активных пародонтальных карманов.
Наряду с этим в последние годы все большее внимание уделяется проблемам использования имплантатов у пациентов с заболеваниями пародонта. Пародонтит у пациентов с частичной адентией раньше нередко являлся причиной отказа от протезирования с использованием внутрикостных дентальных имплантатов, а в настоящее время появился опыт успешного проведения дентальной имплантации у пациентов с заболеваниями пародонта при условии правильной пародонтологической подготовки, постоянного контроля мотивации пациента, поддерживающей пародонтальной терапии [1].
Практически все авторы, в той или иной степени затрагивающие вопросы гигиенического ухода за полостью рта при имплантации, сходятся во мнении, что индивидуальная гигиена зубов, имплантатов и супраконструкций оказывает существенное влияние на стабильность искусственных опор, а от ее качества зависит срок службы имплантата и вероятность развития воспаления вокруг него [4, 11]. Программа ухода за полостью рта после протезирования на внутричелюстных имплантатах базируется на основе индивидуальных особенностей ортопедической конструкции, строения челюстей и расположения зубов.
Обязательно обучение применению таких дополнительных средств гигиены, как суперфлоссы, интердентальные ершики, монопучковые зубные щетки, ирригаторы. Гигиенические мероприятия, являющиеся неотъемлемой составляющей санации полости рта, при дентальной имплантации приобретают еще большее значение в связи с тем, что способствуют снижению риска осложнений и гарантируют долгосрочность успеха имплантации.
Пародонтит у пациентов с частичной адентией раньше нередко являлся причиной отказа от протезирования с использованием внутрикостных дентальных имплантатов
Имплантаты имеют тенденцию накапливать больше бактериального налета и плотных отложений, чем зубы. Вместе с тем для проведения профессиональной гигиены в области имплантатов нет возможности использовать многие из традиционных доступных методов, в частности, нельзя применять обычные металлические ручные и ультразвуковые инструменты, нельзя полировать с использованием абразивных паст и циркулярных щеток и воздушно-абразивных методик с классическим порошком бикарбоната натрия, так как это может повредить структуру поверхности и повысить вероятность ретенции микробного налета.
По данным [12], применение технологии Perio Flow (воздушно-абразивная над- и поддесневая обработка порошком глицина диметром частиц 25 мкм) (EMS, Швейцария) позволяет удалить 99,9 % биопленки, не повреждая поверхности имплантата, и нами для лечения пациентов с пародонтитом и воспалением в области имплантатов был выбран именно этот метод.
Целью нашей работы стала оценка клинической эффективности метода Perio Flow в комплексном лечении периимплантита и периимплантатного мукозита у пациентов с сопутствующей патологией пародонта по сравнению с традиционными методами.
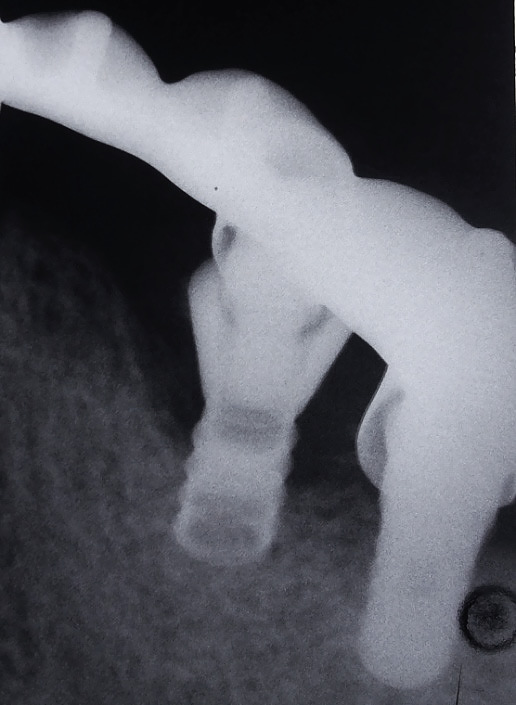
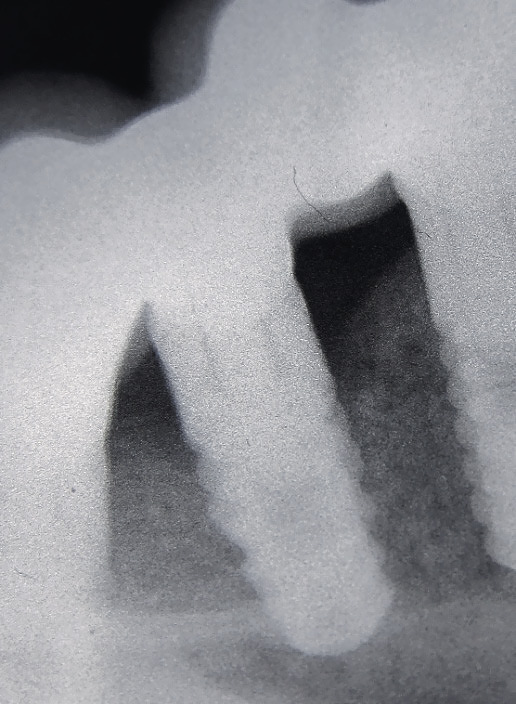
Для этого нами были изучены непосредственные и отдаленные результаты лечения периимплантита у 17 пациентов пародонтологического кабинета хирургического отделения АУЗ «РСП» в возрасте 24—56 лет (9 мужчин и 8 женщин) — основная группа — и 5 пациентов контрольной группы. Срок пользования имплантатами от 1 года до 7 лет, имплантаты как во фронтальных участках, так и в области премоляров и жевательных зубов (всего 24 имплантата). Не все пациенты обратились с жалобами (кровоточивость, отделяемое из десны, дискомфорт), у 5 пациентов (29,4±0,7 %) периимплантит был диагностирован во время осмотра. Диагноз периимплататный мукозит — у 2 пациентов, у остальных периимплантит, подтвержденный рентгенологически (рис. 1, 2).
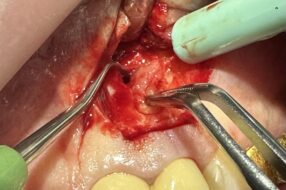
Сопутствующим стоматологическим заболеванием у 6 пациентов (35,29 %) был хронический генерализованный пародонтит в стадии обострения — легкой степени (ХГПЛС), у 11 (64,71 %) — средней степени тяжести (ХГПСС). Контрольную группу составили 5 человек (3 ХГПЛС, 2 ХГПСС), этим пациентам проводилось стандартное лечение (профессиональная гигиена пьезоэлектрическим аппаратом в области имплантатов инструментом с пластиковым покрытием (рис. 3), удаление налета неабразивными пастами механическим методом.
Многоразовый автоклавируемый инструмент, которым проводилась очистка имплантатов от зубных отложений, имеет полиэфиркетонкетоновое покрытие, безопасное для поверхности имплантатов и керамики, работает с пьезоэлектрическим наконечником посредством присоединения через эндочак на 120 0 (рис. 4).

Рис. 3. Инструмент PI для профессиональной гигиены имплантатов ультразвуковым методом и его работа в полости рта.
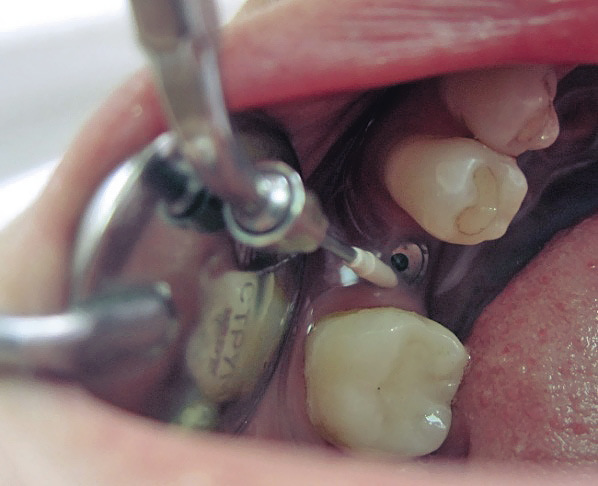
Рис. 4. Инструмент PI для профессиональной гигиены имплантатов ультразвуковым методом и его работа в полости рта.
В основной группе, помимо стандартной профессиональной гигиены, проводилось удаление биопленки методом поддесневой воздушной полировки Perio Flow на 2-й день (2-е посещение), через 6 недель (5-е посещение). В комплекс лечения в обеих группах включались мотивация рациональной гигиены полости рта (ГПР), обучение пациентов особенностям гигиены при наличии дентальных имплантатов с индивидуальным подбором основных и дополнительных средств гигиены, местная и (по показаниям) общая противомикробная и противовоспалительная терапия, витаминотерапия, местная иммунокоррекция, физиотерапия.
Эффективность лечения, проводимого в каждой группе, оценивалась с помощью общепризнанных клинических методов — оценки глубины зондирования вокруг имплантата или периимплантатного кармана (ПИК), цвета периимплантатной десны, консистенции, наличия или отсутствия экссудата из периимплантатной бороздки (кармана), величины периимплантатной маргинальной костной резорбции, упрощенного индекса гигиены полости рта (ГПР) OHI-S (J. C. Green, J. K. Vermillion, 1963), индекса для количественного определения налета в придесневой области Silness-Loe (S-L) (Silness J., Loe, H., 1964), индекса PMA (papillar-marginal-alveolar) (I. Schour, M. Massler, 1947, в модификации С. Parma, 1960).
По показаниям проводилась прицельная рентгенография. Оценку клинических параметров и индексную оценку проводили в каждое из посещений пациента (на 1, 2, 5-й и на 10-й день, через 6 недель, через 3 и 6 месяцев) — всего 7 посещений.
Полученные результаты анализировались при помощи стандартных статистических методов.
Результаты проводимого исследования показали, что клинический статус пациентов до лечения во всех группах был примерно одинаков. Высокие показатели индекса Silness-Loe (2,35±0,2 в основной и 2,28±0,1 в контроле) и OHI-S (2,81±0,22 и в основной и 2,65±0,51 в контроле) указывали на то, что практически у всех пациентов была неудовлетворительная ГПР. Индекс PMA составил в среднем 58,5±2,8 % в основной и 57,3±2,4 % в контрольной группах.
Применение технологии Perio Flow позволяет удалить 99,9 % биопленки, не повреждая поверхности имплантата
Согласно проведенным исследованиям, уровень ГПР (по значениям индекса OHI-S), изначально незначительно различавшийся в обеих группах пациентов, на 5-й день от момента начала лечения в основной группе достиг 0,38±0,33 и держался на этом уровне и к 5-му посещению (через 6 недель), в контрольной же группе уровень гигиены был хуже и, снизившись к 4-му посещению (через 10 дней) до 0,48±0,27, через 6 недель составлял 0,53±0,23 (p<0,001).
Уровень индекса гигиены придесневой области Silness-Loe на фоне проводимой терапии значительно снизился на фоне инструктажа по гигиене и проводимой терапии в обеих группах, немного увеличившись к 5-му посещению (через 6 недель), а в последующие посещения уже имелась разница в значениях индекса: в основной группе через 3 месяца — 0,92±0,31, в контрольной — 1,96± 0,38(p<0,001), через 6 месяцев в основной — 0,87±0,11, а в контроле почти достиг исходного уровня — 2,14±0,23 (p<0,001).
В результате исследования установлено, что в процессе лечения состояние тканей десны вокруг имплантатов, характеризующееся индексом PMA, улучшилось в обеих группах, оставаясь практически весь период лечения стабильным в основной группе: 12,1±0,8 — 11,7±0,6 — 11,9±0,9 в 5, 6 и 7-е посещения соответственно. В контрольной группе к 6-му и 7-му посещению ухудшилось по сравнению с результатом через 6 недель 13,6±1,7 — 16,9±1,3 — 17,8±2,1.
В результате проведенного лечения было зафиксировано уменьшение глубины ПИК в обеих группах. Причем в основной группе отмечена большая редукция глубины ПИК и через 6 недель, и через 3 месяца, и через 6 месяцев (p<0,01) по сравнению с контролем (табл. № 1).
Таблица № 1. Средние значения глубины периимплантатного кармана у пациентов с периимплантитом, мм
| Время | Группы | |
| Основная | Контрольная | |
| До лечения | 5,43±0,32 | 5,34±0,42 |
| Через 6 недель | 4,21±0,28 | 5,03±0,45 |
| Через 3 месяца | 4,12±0,38 | 4,84±0,25 |
| Через 6 месяцев | 3,75±0,41 | 4,75±0,51 |
По данным клинического исследования нами установлено, что уже на 5-й день после начала лечения значения индекса придесневого налета, упрощенного индекса гигиены, пародонтального индекса снизились. При этом различия между значениями изучаемых индексов до лечения и через 5 дней после его начала были статистически достоверными при анализе терапии с Perio Flow по сравнению с традиционным методом.
Клиническими исследованиями подтверждалось уменьшение воспалительной инфильтрации в тканях десны около имплантатов. В основной группе с применением метода Perio Flow отмечалось более заметное и быстрое улучшение по ряду клинических показателей. В контрольной группе через 3 месяца и через 6 месяцев у некоторых пациентов наблюдался рецидив воспаления и ухудшение гигиенических показателей, что отражено в индексах. Пациентам провели снятие образовавшегося налета и были даны дополнительные инструкции по гигиене полости рта.
Сравнительный анализ двух методов по показателям редукции глубины ПИК выявил статистически достоверную наибольшую эффективность исследовательского метода по сравнению с контролем (p<0,01). Через 3 месяца и 6 месяцев от начала лечения исследовательский метод привел к более значительному уменьшению глубины ПИК по сравнению с методом, используемым в контрольной группе.
В нормальных условиях за первый год после имплантации потеря кости должна быть в пределах 1—1,5 мм, а затем замедлиться и составлять 0,2 мм каждый последующий год
Рекомендуемый намиграфик динамического наблюдения пациентов с дентальными имплантатами и сопутствующей патологией пародонта: через месяц после имплантации, далее каждые 3—4 месяца, при стойкой ремиссии — не реже 2—3 раз в год. При осмотре оценивается цвет, структура и консистенция десны, наличие гиперемии, отека и экссудата. При необходимости проводится легкое зондирование, оценивается подвижность, фиксация протеза, наличие зубных отложений (индексы гигиены и при необходимости пародонтальные индексы: индекс кровоточивости, индекс распространенности воспалительного процесса).
Рентгенография проводится, если есть патология, и повторяется через каждые 12 месяцев, чтобы проверить уровень кости. После имплантации атрофия кости неизбежна, ее первичная потеря вокруг имплантата связана не с бактериями, по сути, является тканевым ответом на стоматологическое вмешательство, также может быть связана с излишней или недостаточной нагрузкой на еще не созревшую, полностью не минерализовавшуюся кость. В норме за первый год после операции потеря кости должна быть в пределах 1—1,5 мм, а затем замедлиться и составлять 0,2 мм каждый последующий год.
Применение метода Perio Flow в комплексном лечении периимплантита у пациентов с сопутствующим заболеванием — пародонтит повышает клиническую эффективность традиционной терапии. Учитывая этиопатогенетические аспекты периимплантита и свойства метода, наиболее перспективным звеном в комплексном лечении и профилактике периимплантита у пациентов с пародонтитом является применение безопасного для имплантатов метода удаления биопленки. Наряду с особенностями профессиональной гигиены необходимы соблюдение пациентом графика регулярных посещений пародонтолога в рамках поддерживающей пародонтальной терапии и постоянный контроль качества индивидуальной гигиены.
Список литературы находится в редакции