Применение антигомотоксической терапии в комплексном хирургическом лечении одонтогенных кист
Совершенствование методов хирургического лечения больных с одонтогенными кистами челюстей, профилактики их воспалительных осложнений после хирургического вмешательства является одной из актуальных проблем в челюстно-лицевой хирургии. Среди операций, выполняемых хирургами-стоматологами в условиях амбулаторной клиники, операции по поводу удаления одонтогенных кист челюстей занимают второе место после обычного удаления зуба (Соловьев М. М. с соавт., 2004; Аснина С. А., 2012).
Введение
Стандартным методом оперативного лечения одонтогенных образований является цистэктомия с одномоментной резекцией верхушки корня причинного зуба. Микрофлора, локализующаяся в замкнутых полостях, часто является причиной возникновения воспалительной реакции (Ботбаев Б. Д., 1990; Ефимов Ю. В., 1993), поэтому в ходе поэтапного хирургического лечения устранение бактериальной инфекции в ране осуществляется различными антисептиками (Губайдуллина Ж. Я., 2007). Однако к данным препаратам имеются претензии, обоснованные на способности эндодонтической микрофлоры приобретать к ним резистентность (Ханенко О. Н. и соавт., 2006).
Имеются рекомендации о необходимости применения антибиотиков при хронических воспалительных инфильтратах, развившихся вследствие периапикальных абсцессов. Между тем практически отсутствуют данные, постулирующие о необходимости повального назначения антибиотиков в стоматологической практике (Камаев К. С., 2009).
В то же время широкое признание гомеопатии как одного из методов практической медицины обусловило увеличение в последние годы производства одно- и многокомпонентных гомеопатических лекарственных средств. Правильно подобранное гомеопатическое средство способно прервать обострение заболевания на любой стадии его развития, предотвратить или облегчить последующие обострения, обеспечить стойкую ремиссию. (Бадья Л. Н., Бадья Е. А., 2008). Все вышеприведенные рекомендации о назначении и применении гомеопатических средств требуют достоверной оценки их преимущества по сравнению с аллопатической терапией, которая включает назначение антибиотиков, противовоспалительных препаратов и др.
Цель исследования
Для сокращения сроков реабилитации пациентов и возникновения рецидивов заболевания в послеоперационном периоде разработать алгоритм хирургического лечения одонтогенных кист с применением антигомотоксической терапии.
Материалы и методы
Обследование и хирургическое лечение 73 пациентов (45 женщин и 28 мужчин) в возрасте от 23 до 73 лет (mean 44,2±1,7 года) с одонтогенными кистами проводилось на базе амбулаторного хирургического отделения Центра стоматологии и челюстно-лицевой хирургии ГБОУ ВПО «МГМСУ» им. А. И. Евдокимова Минздрава России (главврач Б. И. Родивилов).
Критерий включения: пациенты обоего пола, любого возраста с кистогранулемами и радикулярными кистами челюстей. Критерий невключения: пациенты с истинными кистами, резидуальными кистами, кератокистами, одонтогенными опухолями доброкачественного и злокачественного генеза, патологическими дефектами костной ткани челюстей. Критерий исключения: пациенты с соматической патологии в период обострения заболевания, развитие пульпита, периодонтита, гингивита и пародонтита в различной стадии воспаления, нежелание пациента участвовать в исследовании.
Все пациенты с одонтогенными кистами челюстей были распределены на группы методом случайной выборки и имели одинаковую возможность получить хирургическое лечение с использованием антигомотоксической или традиционной терапии. Первая группа (основная) была представлена 32 пациентами (10 мужчин и 22 женщины) в возрасте от 23 до 65 лет (mean 45,9±2,26 года), которым проводилась цистэктомия в комплексе с антигомотоксической терапией.
Во вторую группу (группа сравнения) вошел 41 пациент (18 мужчин и 23 женщины) в возрасте от 24 до 74 лет (mean 42,9±2,47 года). Этим пациентам проводилась традиционная цистэктомия с применением стандартной антибиотикотерапии. Контрольная группа была представлена 6 мужчинами и 4 женщинами в возрасте от 40 до 50 лет, которые выступали в качестве контроля состояния тканей периапикальной области.
За несколько часов до хирургического лечения по методу Partch I и Partch I при необходимости пациентам проводилось эндодонтическое лечение корней зубов, расположенных в области кисты
Субъективную и объективную оценку состояния пациентов оценивали до и после операции и заносили в специальную таблицу. Протокол клинического обследования пациентов включал следующие критерии: сбор анамнеза, осмотр, перкуссия и пальпация зубов и тканей полости рта, выполнение цифровой ортопантомографии и/или внутриротовой контактной рентгенографии для оценки очага деструкции костной ткани и регенерации костного дефекта через 3, 6 и 12 месяцев. Оценку болевого синдрома проводили с учетом субъективных ощущений пациента до хирургического вмешательства и на 1, 3 и 7-й дни после операции по аналогово-визуальной шкале (Visual Analog Scale, VAS).
Степень выраженности коллатерального отека слизистой оболочки у пациентов оценивали визуально до операции, на 1, 3 и 7-й дни в области операционной раны. Отмечали сглаженность переходной складки, флюктуацию, а также наличие выделяемого экссудата. Операционную рану, ушитую швами, у пациентов осматривали на 1, 3 и 7-е сутки после операции. Визуально по предложенной нами оттеночной шкале отмечали наличие или отсутствие признаков воспаления переходной складки по интенсивности окраски слизистой оболочки в зоне оперативного вмешательства. Оценку состояния периапикальных тканей зуба проводили по индексу PAI (по S. Huumonen и D. Qrstavik, 2002).
За несколько часов перед хирургическим лечением при необходимости пациентам проводилось эндодонтическое лечение корней зубов, расположенных в области кисты. Операции выполнялись по методу Partch I (для больших кист, проросших в гайморову пазуху и при значительном истончении костной стенки) и Partch II (для одонтогенных образований небольших размеров).
Пациентам 1-й группы (n = 32) с кистогранулемами и радикулярными кистами челюстей проводилась медикаментозная подготовка по предложенной нами схеме:
- За 3 дня до операции сублингвально назначались гомеопатические препараты «Лимфомиозот» по 10 капель 3 раза в день и «Траумель С» в таблетках по 0,3 г 3 раза в день.
- За 30 минут до операции в область предполагаемого удаления одонтогенной кисты по переходной складке проводилась инъекция гомеопатического препарата «Траумель-С» в объеме 2 мл.
- Проводниковая анестезия препаратами артикаинового ряда.
- Орошение операционного поля 0,5%-ным раствором хлоргексидина биглюконата.
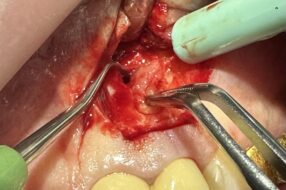
- Выполнение операции цистэктомии.
- Перед закрытием костного дефекта его орошение гомеопатическим препаратом «Траумель-С» в объеме 1 мл. При дефектах больших размеров применение остеопластического материала «Остеопласт-М».
- Мобилизация и ушивание слизисто-надкостничного лоскута «на себя» нитками викрил № 4,0.
- Пациентам в послеоперационном периоде рекомендовали прием комплекса гомеопатических препаратов сублингвально за 15—20 минут до употребления пищи:
- «Спаскупрель» в таблетках 0,3 г 3 раза в сутки в течение 3—5 дней в зависимости от болевой симптоматики;
- «Лимфомиозот» 3 раза в сутки по 10 капель в течение 12 дней;
- «Траумель С» в таблетках 0,3 г 3 раза в сутки в течение 24 дней;
- «Остеохель» через 6 дней после операции в таблетках 0,3 г 3 раза в сутки в течение 24 дней.
Пациентам 2-й группы (n = 41) с кистогранулемами и радикулярными кистами челюстей операции выполнялись с использованием стандартных антибактериальных и противовоспалительных препаратов.
Для оценки заживления раневого дефекта в качестве критерия была использована десневая жидкость (ДЖ). Образцы ДЖ с помощью полосок из хроматографической бумаги в течение 5 минут отбирались из десневой борозды зубов здоровых волонтеров, не имеющих одонтогенных челюстных полостей и воспалительных изменений в пародонте, и у пациентов с одонтогенными кистами до операции, через 3 и 7 дней и 1 месяц после операции.
Полученную полоску с ДЖ помещали в пластиковую пробирку с крышечкой, содержащую 0,5—1,0 мл физиологического раствора, и оставляли для элюации при температуре +4 °С на 4 часа при периодическом помешивании. В элюате ДЖ на анализаторе StatFax-2200 (США) иммуноферментным методом определяли количество (пг/мл) интерлейкина-1β (ИЛ-1β) и лактоферрина (ЛФ) (ЗАО «Вектор-БЕСТ», Россия).
Все полученные в процессе обследования цифровые данные были подвергнуты статистической обработке методами вариационной статистики с использованием программы Microsoft Excel и пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
В настоящей работе наше клиническое обследование пациентов от 23 до 73 лет на дооперационном этапе выявило, что на болевые ощущения предъявляли жалобы 56,2 % пациентов с кистозными образованиями. При осмотре у 13,7 % пациентов имелись деформации в челюстно-лицевой области, а у 19,2 % пациентов выявлено наличие свищевых ходов на поверхности слизистой оболочки альвеолярного отростка. У 58,9 % пациентов кистозные образования возникли в ранее леченных зубах, а у 41,1 % пациентов явились последствиями осложненного кариеса.
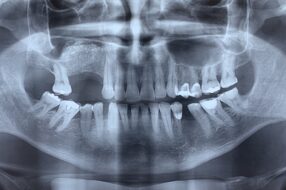
Одонтогенные кисты челюстей выявлены в 72 зубах верхней челюсти и в 41 зубе нижней челюсти, и их диаметр колебался от 0,5 до 12 см. В центральных и боковых резцах верхней челюсти выявлено наибольшее число одонтогенных кист — 22 зуба. Альвеолярный сегмент только у 1 зуба охватывали 68 % одонтогенных образований, у 2 зубов — 20 %, у 3 зубов — 9 %, у 4 зубов и более — всего 3 %. У женщин в патологический очаг верхней и нижней челюстей было вовлечено в 2 раза больше зубов, чем у мужчин.
Самые большие одонтогенные кисты челюстей наблюдались у пациентов среднего (от 31 до 40 лет) и старшего возраста (от 51 до 60 лет), а небольшие кисты и кистогранулемы были характерны для пациентов от 41 до 50 лет. Размеры кистозных образований не зависели от пола, возраста, соматического статуса пациентов и локализации на челюсти.
Результаты рентгенологического исследования до операции по периапикальному индексу PAI показали, что в основной группе (I, n = 32) у 14 (43,7 %) пациентов он был равен 3 баллам, у 11 (34,4 %) пациентов — 4 баллам, а у 7 (21,9 %) — 5 баллам. В группе сравнения (n = 41) индекс PAI у 32 (78,1 %) человек был равен 3 баллам, у 6 (14,6 %) человек — 4 баллам, а у 3 (7,3 %) — 5 баллам.
Самые большие одонтогенные кисты челюстей наблюдались у пациентов среднего (от 31 до 40 лет) и старшего возраста (от 51 до 60 лет), а небольшие кисты и кистогранулемы — у пациентов от 41 до 50 лет. При этом размеры не зависели от пола, возраста, соматического статуса пациентов и локализации на челюсти
На фоне комплексного лечения после хирургического вмешательства в основной группе пациентов имело место более быстрое исчезновение болевого синдрома, гиперемии СОПР и локального отека в области операционной раны. Согласно данным об интенсивности болевого синдрома в основной группе на 3-и сутки 71,9 % пациентов ощущали слабовыраженную боль, у 18,7 % пациентов боль была выражена умеренно, у 9,4 % пациентов болезненные ощущения были выражены сильнее. Ни один из пациентов этой группы не отмечал очень сильно выраженную болевую реакцию. На 7-е сутки уже 78,1 % пациентов не ощущали болезненности в области операционной раны, 18,8 % отмечали слабовыраженную боль и оценивали ее от 2 до 4 баллов и только 3,1 % пациентов жаловались на умеренно выраженную болезненность.
У пациентов группы сравнения на 3-и сутки после оперативного вмешательства на слабовыраженную боль указали 58,6 % пациентов, умеренно выраженную боль — 9 человек, что составило 21,9 %, 6 человек (14,6 %) жаловались на сильно выраженную боль и 2 человека (4,9 %) — на очень сильную боль. То есть в этой группе пациентов, которым была назначена аллопатическая лекарственная терапия 19,5 % из числа обследованных на 3-и сутки после операции испытывали выраженную и очень сильно выраженную боль. На 7-е сутки 12,2 % пациентов группы сравнения, несмотря на прием противовоспалительных и антибактериальных препаратов, продолжали жаловаться на сильные болевые ощущения, тогда как на умеренную болевую реакцию указали 7,3 % человек. На отсутствие боли указали 36,6 % человек, что было в два раза меньше, нежели в основной группе.
Оценка продолжительности болевого синдрома показала, что в группе сравнения этот показатель составил 2,6±0,44 суток (в среднем 4,43±0,31 балла на 3-и сутки и 2,65±0,35 балла на 7-е сутки), что немного больше, чем в основной, где он равен 2,1±0,13 суток (в среднем 4,03±0,29 балла на 3-и сутки и 1,06±0,25 балла на 7-е сутки) (р>0,05).
Определенные различия между группами пациентов выявлялись не только в продолжительности развившейся гиперемии слизистой оболочки ротовой полости, но и в степени интенсивности.
Детальное изучение показало, что у пациентов основной группы интенсивность гиперемии к 7-м суткам заживления раны уменьшилась от 1 до 4 баллов. Однако у 5 пациентов, у которых на 3-и сутки показатели интенсивности гиперемии сохранялись на высоком уровне, к 7-м суткам эти значения приобрели не столь выраженную форму. У 71,9 % пациентов слизистая оболочка имела розовый цвет без признаков гиперемии. То есть на фоне проводимой антигомотоксической терапии к 7-м суткам у 71,9 % пациентов отсутствовали признаки воспаления, а у 28,1 % они были слабовыраженны.
На фоне проводимой антигомотоксической терапии к 7-м суткам у 71,9 % пациентов отсутствовали признаки воспаления, а у 28,1 % они были слабовыраженны
В группе сравнения на фоне проводимой стандартной терапии в послеоперационном периоде слизистая оболочка приобрела розовый цвет только у 48,9 % пациентов, у 26,8 % обследованных и 9,7 %, соответственно, степень гиперемии была очень слабо и слабовыраженна. Однако у 12,2 % пациентов гиперемия слизистой оболочки в области операционной раны была умеренно выражена и у 1 пациента сильно выражена. То есть интенсивность воспалительной реакции сохранялась у 14,6 % пациентов через 1 неделю после операции.
Длительность гиперемии слизистой оболочки полости рта у пациентов группы сравнения в среднем составила 5,57±0,39 суток (в среднем 3,80±0,21 балла на 3-и сутки и 1,92±0,18 балла на 7-е сутки), а в основной группе этот показатель достигал 4,38±0,13 суток (в среднем 3,15±0,21 балла на 3-и сутки и 1,53±0,17 балла на 7-е сутки) (р>0,05).
Об уменьшении выраженности воспаления в обеих группах, но с разной скоростью свидетельствовал показатель уменьшения локального отека, который мы также выразили в баллах. На 3-и сутки после операции локальный отек в области операционной раны отсутствовал только у 5 пациентов основной группы, слабовыражен он был у 56,3 % лиц основной группы против 24,3 % обследованных пациентов группы сравнения. На 7-е сутки явления коллатерального отека исчезли у 71,9 % оперированных пациентов основной группы и у 58,6 % пациентов группы сравнения. В основной группе пациентов определялся преимущественно слабовыраженный (9,4 %) и умеренно выраженный (18,7 %) коллатеральный отек.
В группе сравнения у большего числа лиц на 3-и сутки имелась умеренно выраженная и сильно выраженная отечность (48,9 % и 26,8 % соответственно). На 7-е сутки заживления раны у 21,9 % пациентов группы сравнения имелись признаки слабо выраженного отека и у 19,5 % — умеренно выраженного отека. Средний срок купирования локального отека у пациентов группы сравнения составил 7,4±0,54 суток (в среднем 2,02±0,11 балла на 3-и сутки и 0,60±0,12 балла на 7-е сутки), а в основной группе 6,3±0,24 суток (в среднем 1,22±0,15 балла на 3-и сутки и 0,46±0,14 балла на 7-е сутки) (р>0,05).
Данные рентгенологического исследования через шесть месяцев после операции показывали значительное уменьшение размеров костного дефекта, но без полного восстановления структуры костной ткани
Через 1 месяц визуальное обследование в обеих группах не выявило признаков гиперемии и локального отека СОПР. На переходной складке слизистой оболочки в области наложения швов имелись малозаметные рубцы. Пальпация безболезненная, в области оперированного участка челюсти определяется неуплотненная мягкая кортикальная пластинка. Клиническое обследование во всех группах, проведенное через 3 месяца после операции, выявило положительный результат. Пациенты не предъявляли жалоб, область операционной раны при пальпации была безболезненна. В сравниваемой и основной группах при пальпации оперированного участка челюсти по поводу малых и средних кист определялась плотная костная ткань.
У 100 % пациентов основной группы, которым назначалась антигомотоксическая терапия, через 6 месяцев после операции на рентгенограммах наблюдалось уменьшение размеров костного дефекта на 1/2 и 1/3 за счет незрелого костного регенерата. Через 12 месяцев после операции на рентгенограммах определялся дефект костной ткани с нечеткими контурами, по краям которого располагались костные балочки, что свидетельствовало о незавершенной регенерации кости. Процессы резорбции и синтеза кости распространялись от периферии костной полости к центру.
Полное восстановление структуры костной ткани через 6 месяцев наблюдалось в случае удаления одонтогенных образований до 1,5 см в диаметре. Через 12 месяцев у пациентов с исходными размерами костных дефектов от 0,5 до 1,5 см через 6 месяцев отмечалось полное восстановление костной ткани. У пациентов, у которых изначально имелась величина костного дефекта от 2 до 3 см с сохраненными стенками, выявлялось полное замещение дефекта собственной костью только через 12 месяцев.
В группе сравнения, согласно рентгенологическому исследованию, после операции с ведением раны по традиционной методике (кровяный сгусток) восстановление костной ткани в области дефекта происходило иначе. Данные рентгенологического исследования через 6 месяцев после операции показывали значительное уменьшение размеров костного дефекта, но без полного восстановления структуры костной ткани.
Через 12 месяцев после операции на рентгенограммах определялся дефект костной ткани. Контуры дефекта были нечеткие, по краям дефекта видны костные балочки, свидетельствующие о медленно протекающем процессе регенерации костной ткани. У пациентов с исходными размерами одонтогенных кист от 1,0 до 1,5 см наблюдалось заполнение дефекта молодой костной тканью. В остальных случаях, когда размеры кисты превышали 1,5 см, происходило уменьшение очага деструкции на 3/4 от исходного размера.
Через 6 месяцев после операции отмечено значительное уменьшение размеров костного дефекта, но без полного восстановления структуры костной ткани
У пациентов основной группы через 3 месяца обследования в 81,3 % случаев выявлялось сокращение индекса PAI: до 1 балла в 56,3 % случаев, до 2 баллов в 25 % случаев. Через 6 месяцев у 71,9 % пациентов индекс PAI был в норме, а через 12 месяцев эта цифра достигала 81,3 %. В группе сравнения через 3 месяца у 63,4 % пациентов индекс PAI был равен 1 баллу и у 26,8 % пациентов — 2 баллам. Через полгода после операции у 85,4 % данный индекс соответствовал норме, к 12-му месяцу репарации тканей эти значения еще больше снизились и достигали 95,2 %.
Замедленная регенерация тканей выявлена у 3,1 % пациентов, лечившихся комплексной гомеопатической терапией, и в 2,4 % случаев у пациентов, лечившихся традиционным методом. Это зависело от того, что в основной группе было 5 пациентов с радикулярными кистами, захватывающими 3 и более альвеолярных сегментов, тогда как в группе сравнения было всего 2 человека с большим диаметром кист.
Состояние операционного поля также оценивали по выделению тканевой жидкости через десневой желобок в области причинного зуба. Полученные данные были сопоставлены как в различные сроки обследования, так и с результатами лиц контрольной группы, не имеющих воспалительного процесса в пародонте.
Сопоставление результатов по исследованию элюата ДЖ (табл. № 1) показало, что до операции при наличии одонтогенных образований количество ИЛ-1β было увеличено в десятки раз (р<0,001) и в элюате ДЖ присутствовал белок лактоферрин, отсутствующий в норме.
Таблица № 1. Показатели элюата десневой жидкости пациентов основной группы с одонтогенными кистами челюстей в динамике заживления раневого дефекта.
Сроки наблюдений |
Число наблюдений, n |
Диаметр одонтогенного образования, см |
Показатели ДЖ, пг/мл |
|
ИЛ-1β |
ЛФ |
|||
| До операции | 22 | до 1 | 50,2±27,4 | 5,50±2,14 |
| 5 | от 1,1 до 3 | 99,9±11,2 | 9,94±1,01 | |
| 5 | >3 | 434±253 | 12,7±0,17 | |
| На 7-е сутки после операции | 22 | до 1 | 86,5±21,4* | 4,96±1,20 |
| 5 | от 1,1 до 3 | 127±18,5 | 6,03±0,54 | |
| 5 | >3 | 458±198 | 8,20±1,30 | |
| Через 3 месяца после операции | 22 | до 1 | 3,43±0,13** | — |
| 5 | от 1,1 до 3 | 6,43±0,28** | 0,43±0,20** | |
| 5 | >3 | 10,5±1,12** | 1,13±0,06** | |
| Через 6 месяцев после операции | 22 | до 1 | 3,17±0,37** | — |
| 5 | от 1,1 до 3 | 3,60±0,24** | — | |
| 5 | >3 | 3,78±0,51** | 0,46±0,32** | |
| Контрольная группа | 10 | — | 3,30±0,46** | — |
Примечание: различия достоверны при ** р<0,001, * р<0,05 по отношению к исходным значениям до операции.
На 7-е сутки после операции у пациентов обеих групп количество ИЛ-1β недостоверно (р>0,05) возрастало, а содержание лактоферрина существенно не менялось (р>0,5). Полученные данные отражают наличие воспалительной реакции в обеих группах как до операции, так и на 7-е сутки после проведенной цистэктомии независимо от вида назначаемой лекарственной терапии.
Через 3 месяца у пациентов основной группы с одонтогенными образованиями до 1 см количество ИЛ-1β в элюате ДЖ приблизилось к значениям контрольной группы (р>0,5) и не определялся лактоферрин, что соответствовало показателям здорового периодонта. У оперированных пациентов, которым проводили цистэктомию одонтогенных образований диаметром до 3 см и более, в элюате ДЖ сохранялось повышенное содержание ИЛ-1β и лактоферрина (р>0,05 и р<0,001 соответственно). Через 6 месяцев показатели ИЛ-1β и лактоферрина в элюате ДЖ у лиц с удаленными кистогранулемами и одонтогенными кистами диаметром до 3 см не отличались от значений, полученных в контрольной группе. В случае хирургического удаления одонтогенных кист более 3 см в этот срок обследования количество ИЛ-1β также приближалось к показателям контрольной группы (р>0,5), но присутствовали следы лактоферрина.
Исследование количества ИЛ-1β и лактоферрина в элюате ДЖ пациентов группы сравнения в отдаленные сроки (табл. № 2) также выявило положительную динамику в сторону нормализации исследованных показателей.
Таблица № 2. Показатели элюата десневой жидкости пациентов группы сравнения с одонтогенными кистами челюстей в динамике заживления раневого дефекта.
Сроки наблюдений |
Число наблюдений, n |
Диаметр донтогенного образования, см |
Показатели ДЖ, пг/мл |
|
ИЛ-1β |
ЛФ |
|||
| До операции | 31 | до 1 | 50,9±26,5 | 5,33±2,28 |
| 6 | от 1,1 до 3 | 98,1±12,7 | 9,06±1,58 | |
| 5 | >3 | 452±203 | 11,9±0,97 | |
| На 7-е сутки после операции | 31 | до 1 | 79,6±25,8 | 5,43±0,75 |
| 6 | от 1,1 до 3 | 113±16,8 | 5,58±0,45 | |
| 5 | >3 | 462±185 | 9,02±2,15 | |
| Через 3 месяца после операции | 31 | до 1 | 3,98±0,41** | — |
| 6 | от 1,1 до 3 | 6,90±0,50** | 0,38±0,15** | |
| 5 | >3 | 11,2±2,21** | 1,75±0,08** | |
| Через 6 месяцев после операции | 31 | до 1 | 3,50±0,29** | — |
| 6 | от 1,1 до 3 | 3,98±0,39** | — | |
| 5 | >3 | 4,18±0,44** | 0,95±0,66** | |
| Контрольная группа | 10 | — | 3,30±0,46** | — |
Примечание: различия достоверны при ** р<0,001, * р<0,05 по отношению к исходным значениям до операции.
Заключение
Таким образом, комплексное хирургическое лечение пациентов с использованием гомеопатических препаратов «Траумель С», «Лимфомиозот», «Остеохель» и «Спаскупрель» обеспечило более комфортный период для пациентов на ранних сроках заживления раны, что заключалось в снижении болевых ощущений у пациентов, уменьшении интенсивности воспалительной реакции в оперированных тканях по показателям гиперемии и отечности слизистой оболочки по сравнению с пациентами, получавшими стандартную лекарственную терапию. На поздних сроках заживления раны характер регенерации тканей между группами пациентов как с применением гомеопатических препаратов, так и при назначении антибиотиков не имел существенных различий.
В послеоперационном периоде в зависимости от размера кисты на фоне проведенного хирургического вмешательства и антигомотоксической терапии через 3 и 6 месяцев наблюдалась нормализация количества ИЛ-1β и лактоферрина в ДЖ, что свидетельствовало об исчезновении воспалительной реакции в тканях пародонта.
Список литературы находится в редакции.