Роль маркеров воспаления в патогенезе одонтогенных кист
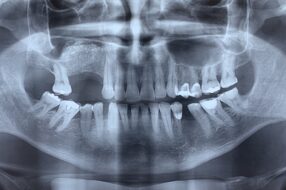
Одонтогенные кистозные образования, согласно классификации ВОЗ (1999), разделяются на абсцессы, гранулемы и кисты. По данным A. Jones и соавт. (2006) и A. B. Bataineh и соавт. (2004), абсцессы встречаются от 5 до 35 % случаев от всех видов челюстно-лицевых патологий, гранулемы от 50 до 77,9 %, а радикулярные кисты от 52 до 68 % случаев. Наиболее часто одонтогенные кисты являются следствием хронического периодонтита, гораздо реже они возникают по причине травмы зубов и челюсти (Cawson R. A. et al., 2002).
Введение
Общеизвестно, что интенсивность развития воспалительной реакции периапикальных тканей зависит от накопления инфильтрата, представленного патогенной микрофлорой, лимфоцитами, мононуклеарными фагоцитами и нейтрофилами (Nair P. N. R., 2003). Проникновение патогенной микрофлоры и ее токсинов за верхушку корня приводит к интоксикации, раздражению и развитию воспаления тканей периодонта (Тимофеев А. А., Ушко Н. А., 2008). В то же время воспаление — это возникшая в ходе эволюции стереотипная защитно-приспособительная местная сосудисто-тканевая реакция живых систем на действие патогенного раздражителя (Маянский Д. Н., 1991).
В ответ на воспаление активируются клетки иммунной защиты, предохраняющие естественные клетки от повреждения. Столкновение микробных захватчиков и ведущих оборонительных сил в локальной зоне заканчивается разрушением большей части периапикальных тканей и формированием различных категорий апикальных повреждений пародонта. При обострении воспаления процесс протекает по экссудативному типу, после стихания острых явлений преобладают продуктивно-пролиферативные компоненты (Романова Ю. М., Гинцбург А. Л., 2000).
Развитие одонтогенной кисты протекает в несколько этапов. Первая фаза начинается с миграции эпителиальных клеток из островков Малассе в зону воспаления под действием воспалительных цитокинов и эйкозаноидов, бактериальных антигенов, фактора роста эпителия, метаболитов бактериальных клеток (Cawson R. A., 2002; Nair P. N. R., 2003).
Воспаление активирует клетки иммунной защиты, предохраняющие естественные клетки от повреждения
Во второй фазе происходит формирование эпителиальной выстилки с образованием полости и внутреннего содержимого. По данным R. A. Cawson (2002), содержимое кисты представляет собой ультрафильтрат плазмы крови, содержащий продукты распада гема, молекулы холестерола и большое количество газообразных веществ — аммиака, углекислого газа и др., выделяемых бактериальной микрофлорой.
В третьей фазе наблюдается рост кисты и разрушение прилежащих тканей. По мере роста одонтогенная киста вызывает вначале атрофию губчатого вещества, а позднее и кортикального слоя костной ткани челюстей (Аснина С. А., 2012). Увеличиваясь до максимальных размеров, одонтогенная киста приводит к деформации челюстно-лицевого скелета.
Изучение молекулярных механизмов патогенеза одонтогенных кист, формирование капсулы в очаге поражения, опосредованное цитокинами, несомненно, является важным для лучшего понимания базовых механизмов функционирования различных клеток при ряде патологических процессов. Полученные знания необходимы как для дифференциальной диагностики, так и для предлагаемого последующего лечения.
Цель исследования
Изучить реакцию клеток периапикальной области в ответ на повреждающий фактор, вызванный ростом одонтогенных кист, по содержанию в биологических образцах провоспалительного интерлейкина-1β и провоспалительного интерлейкина-4, фактора некроза опухолиα, фактора роста эндотелия (изоформа А), лактоферрина и остеокальцина.
Материал и методы исследования
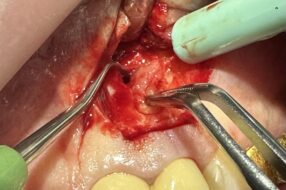
В амбулаторной клинике ГБОУ ВПО «МГМСУ им А. И. Евдокимова» по стандартной схеме, включающей выяснение жалоб, сбор анамнеза, историю развития настоящего заболевания, наличие сопутствующей патологии, было обследовано 73 пациента обоего пола в возрасте от 20 до 45 лет (женщин — 45, мужчин — 28). Этим пациентам по показаниям было проведено плановое оперативное лечение кистогранулем и радикулярных кист челюстей с резекцией верхушки корня зуба.
Кисты представляет собой ультрафильтрат плазмы крови, содержащий продукты распада гема, молекулы холестерола и большое количество газообразных веществ — аммиака, углекислого газа и др.
Анализ сопутствующих заболеваний у обследованных показал, что 30 (41,1 %) пациентов отмечали у себя соматические патологии, а 43 (58,9 %) обследованных отрицали наличие соматических заболеваний. Первичное стоматологическое обследование пациентов проводили с использованием метода лучевой диагностики, которое показало наличие кистозных образований. На всех типах рентгенограмм осуществляли измерение размеров костного дефекта с помощью кронциркуля по диаметру полости. При овальной или эллипсовидной форме дефекта костной ткани измеряли ее максимальный диаметр в горизонтальном и вертикальном направлении. Результаты выражали в см.
Критерий включения: пациенты обоего пола, любого возраста с кистогранулемами и радикулярными кистами челюстей. Критерий невключения: пациенты с истинными кистами, резидуальными кистами, кератокистами, одонтогенными опухолями доброкачественного и злокачественного генеза, патологическими дефектами костной ткани челюстей. Критерий исключения: пациенты с соматической патологии в период обострения заболевания, развитие пульпита, периодонтита, гингивита и пародонтита в различной стадии воспаления, нежелание пациента участвовать в исследовании.
Забор биоптатов оболочек и содержимого полости одонтогенных кист производили во время оперативного вмешательства, под местной анестезией. Оболочки кистозных образований извлекались из челюстей, отмывали от крови и экссудата в 0,9%-ном растворе NaCl. Образцы разрезали на две части. Часть образцов помещали в 10%-ный раствор нейтрального формалина и отправляли на гистологическое исследование для дифференциальной диагностики. Другую часть тканевых образцов взвешивали на торсионных весах с целью расчета объема жидкости для экстракции.
В охлажденных до температуры +4 °С фарфоровых ступках при помощи пестиков образцы оболочек растирали с добавлением кварцевого песка и 0,9%-ного раствора NaCl до гомогенного состояния. Содержимое полости кистозных образований получали открытым и закрытым доступом. В случае открытого доступа с помощью одноразового шприца оболочка кисты пунктировалась, и ее содержимое извлекалось. При закрытом доступе под анестезией пунктировалась интактная слизистая оболочка в зоне проекции радикулярной кисты. В данном случае манипуляции проводились до эндодонтического лечения, для предупреждения преждевременного опорожнения содержимого кисты через открытое апикальное отверстие.
Пробирки с гомогенатами помещали в центрифугу и при 3000 об./мин. в течение 15 минут центрифугировали. Далее пробирки извлекали, дозаторами аккуратно отбирали надосадочную жидкость (супернатант) без встряхивания осадка со дна пробирки и переливали в чистые маркированные пробирки.
В супернатанте биологических образцов на анализаторе StatFax-2200 (США) иммуноферментным методом определяли количество провоспалительного интерлейкина ИЛ-1β (ИЛ-1β), противовоспалительного — ИЛ-4, фактора некроза опухоли-α (ФНО-α), лактоферрина (ЛФ) (производитель ЗАО «Вектор-БЕСТ», Россия), фактора роста сосудистого эндотелия — А (ФРЭ-А) (Bender MedSystems, США) и остеокальцина (Immunodiagnosticsystem, Англия) методом иммуноферментного анализа. Концентрацию исследуемого белка или пептида в образцах выражали в пг/мл (для жидкостей) или пг/мг (для тканевого образца).
Все полученные в процессе обследования цифровые данные были подвергнуты статистической обработке методами вариационной статистики с использованием программы Statistica 6.0. Для анализа взаимосвязи между признаками применялся корреляционный анализ по Спирмену (R Spearmen). Статистически значимыми считались различия при p<0,05.
Результаты и обсуждение
Согласно результатам гистологических исследований, у 73 человек были диагностированы одонтогенные кисты (53 пациента с кистогранулемами и 20 человек с радикулярными кистами челюстей).
Данные лучевой диагностики выявили очаги разряжения, имеющие почти правильную округлую форму и четкие границы. В 7,3 % случаев очаги разрежения были связаны с разрушением кортикальных пластинок. У 4,1 % пациентов патологический очаг сообщался с гайморовой пазухой носа. У обследованных пациентов кистозные образования поражали периапикальную область 113 зубов, из которых 72 зуба (63,7 %) располагались на верхней челюсти и 41 зуб (36,3 %) на нижней челюсти. Так, из выявленных кистозных образований альвеолярный сегмент только у 1 зуба охватывали 68 % кист, у 2 зубов — 20 % , у 3 зубов — 9 % и у пяти и шести зубов на челюсти — 3 % патологических очага.
У 1 пациентки выявлен поликистоз (одна киста на верхней и две на нижней челюсти) с захватом альвеолярных сегментов 2 и 3 зубов соответственно. Размеры одонтогенных кист варьировались: у 72,6 % пациентов от 0,5 до 1 см, у 16,4 % человек от 1,1 до 2 см, у 9,6 % пациентов от 2,1 до 5 см, а у 4,1 % человек от 5,1 см и более.
В биоптатах оболочек и содержимом полости кисты нами было изучено количество ИЛ-1β, ИЛ-4, ФНО-α, лактоферрина, ФРЭ-А и остеокальцина пациентов с одонтогенными кистами. Данные представлены в таблице.
Таблица № 1. Биохимические показатели в биологических образцах пациентов с одонтогенными кистами (M±m).
Показатели |
Размеры одонтогенных кист |
Содержимое полости(пг/мл) |
Биоптаты оболочек(пг/мг ткани) |
|
ФНО-a |
до 1 см |
7,06±0,65 |
— |
|
от 1,1 до 3 см |
19,8±0,66* |
||
|
от 3,1 см и больше |
50,3±7,47**▲ |
||
|
ИЛ-1β |
до 1 см |
55,4±4,69 |
18,3±2,02 |
|
от 1,1 до 3 см |
328±74,4** |
153±30,0** |
|
|
от 3,1 см и больше |
1219±324**▲▲ |
728±148**▲▲ |
|
|
ИЛ-4 |
до 1 см |
0,66±0,04 |
— |
|
от 1,1 до 3 см |
0,87±0,10* |
||
|
от 3,1 см и больше |
2,69±0,44**▲▲ |
||
|
Лактоферрин |
до 1 см |
2,17±0,47 |
11,9±0,57 |
|
от 1,1 до 3 см |
8,75±0,43* |
16,8±1,41* |
|
|
от 3,1 см и больше |
17,7±2,08**▲ |
23,7±1,79*▲ |
|
|
ФРЭ-А |
до 1 см |
376±35,8 |
94,8±12,0 |
|
от 1,1 до 3 см |
716±21,5*▲ |
223±7,92** |
|
|
от 3,1 см и больше |
992±21,9**▲▲ |
621±47,0**▲ |
|
|
Остеокальцин |
до 1 см |
— |
— |
|
от 1,1 до 3 см |
— |
||
|
от 3,1 см и больше |
8,34±4,60**▲▲ |
Примечание: * р<0,05, ** р<0,001 по отношению к кистогранулемам и кистам малого размера (до 1 см); ▲ р<0,05, ▲▲р<0,001 по отношению к кистам среднего размера (от 1,1 до 3 см).
Результаты исследования показали присутствие в содержимом полости кистозных образований ИЛ-1β, ИЛ-4, ФНО-α, лактоферрина, ФРЭ-А. Наибольшее количество данных биологически активных соединений выявлялось в кистах больших размеров (свыше 3 см). Обращает на себя внимание высокое содержание провоспалительного цитокина — ИЛ-1β, в то время как количество ИЛ-4 было достаточно низким.
Мы впервые показали, что в кистозной жидкости содержится защитный белок лактоферрин и его количество также зависело от размера кистозного образования. Кроме того, в кистозной жидкости присутствует фактор роста эндотелия-А и его наименьшее содержание определяется в кистогранулемах и кистах малого размера (до 1 см) и растет по мере увеличения кисты. Исследование костного белка остеокальцина, содержащего остатки γ-карбоксиглутаминовой кислоты, выявило отсутствие данного протеина в содержимом кист малого и среднего размера, и только в трех случаях остеокальцин определялся в кистозной жидкости кист большого размера.
Результаты исследования показали присутствие в содержимом полости кистозных образований ИЛ-1β, ИЛ-4, ФНО-α, лактоферрина, ФРЭ-А. Их наибольшее количество выявлялось в кистах больших размеров (свыше 3 см)
В оболочках одонтогенных кист не определялись ИЛ-4, ФНОα и остеокальцин. Согласно данным литературы, клетки эпителия являются источником различных провоспалительных цитокинов и протеиназ, являющихся непосредственными участниками воспаления и участвующих в резорбции окружающих тканей (Быков В. Л., 2003). Это подтверждают и полученные нами данные, свидетельствующие об интенсивном скоплении полиморфноядерных лейкоцитов по количеству синтезируемого ими интерлейкина-1β, и уровень этого цитокина нарастает в зависимости от размеров кисты. Наряду с этим наблюдается увеличение лактоферрина — белка, ответственного за антибактериальную защиту.
Выявляемое в полостной жидкости наибольшее количество белков и пептидов, позволяет использовать ее в качестве диагностического критерия развития патологического процесса. Различия в составе полостной жидкости и оболочке одонтогенного образования лишний раз подтверждают надежную изоляцию содержимого кисты от окружающих тканей пародонта. Наличие противовоспалительных компонентов ИЛ-4 и ФНОα в составе полостного содержимого определяют клетки моноцит-макрофагальной линии. ФНОα участвует не только в защитных реакциях, но и служит одним из медиаторов деструкции тканей, обычной при длительном, хроническом воспалении.
Увеличивающее количество ФНОα по мере роста кисты может быть опосредовано его участием в индукции пролиферативной активности фибробластов и депозиции коллагеновых белков, которые участвуют в формировании соединительнотканной наружной оболочки кисты. Противовоспалительные цитокины, в частности ИЛ-4, принимают участие в ограничении воспалительного ответа, подавляя секрецию провоспалительных цитокинов ИЛ-1, ИЛ-6, ИЛ-8, ФНО, супероксидных анион-радикалов и простагландина E2, и, таким образом, смягчают тяжесть повреждения тканей.
В кистозной жидкости содержится защитный белок лактоферрин и его количество также зависит от размера кистозного образования
На фоне одновременного роста уровня ИЛ-1β, ФНОα и одонтогенной кисты количество ИЛ-4 невелико. Такой дисбаланс в количестве провоспалительного и противовоспалительного цитокинов в содержимом одонтогенного образования и отсутствие ИЛ-4 в оболочке кисты в воспалительный период, возможно, влияют на характер иммунного ответа организма на развитие кисты.
Количество фактора роста эндотелия-А во всех образцах оболочек и полостном содержимом было самым большим. Известно, что фактор роста эндотелия, как и другие факторы роста, считается предиктором пролиферативной активности клеток эпителия, он также участвует в формировании сосудистой капиллярной сети вокруг стенки радикулярной кисты. Учитывая, что фактор роста эндотелия сосудов — это стрессиндуцированный пептид и его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, его повышение можно рассматривать как адаптационный ответ на дефицит кислорода, возникший при воспалении (Петрова Л. В. с соавт., 2004).
Еще один путь экспрессии ФРЭ-A происходит через вовлечение воспалительных клеток, секретирующих цитокины ФНО-α и ИЛ-1β (Thornton A. D. et al., 2006). Каждое увеличение тканевой массы сопровождается неоваскуляризацией, что поддерживает сосудистую плотность. Таким образом, механизм этого адаптивного ответа в том, что относительный недостаток кислорода приводит к повышению ангиогенных стимулов.
Существует ряд клеток, способных повышать уровень ФРЭ-A in vitro во время гипоксии, к которым относятся фибробласты и эндотелиальные клетки, а также некоторые опухолевые клетки (Carmeliet P., 2003, 2005). В связи с этим полученные результаты свидетельствуют о развитии воспалительной реакции, нарастающей гипоксии клеток и интенсивном формировании сосудистого русла вокруг оболочки кисты.
Заключение
Таким образом, результаты исследования показали, что одонтогенным кистам присущи все признаки воспаления, которые не редуцируются. В то же время затяжное воспаление может иногда приводить к малигнизации кистозной капсулы больших одонтогенных кист. Ранее методом иммуногистохимии было показано присутствие остеопонтина и остеокальцина в эпителиальных челюстных опухолях, поэтому в нашем исследовании наличие остеокальцина в содержимом кист совпало с результатами гистологического исследования, показавшими перерождение кисты в злокачественную опухоль.
ЛИТЕРАТУРА
1. Аснина С. А. Одонтогенные кисты челюстей: учебное пособие / С. А. Аснина; под ред. проф. А. Ю. Дробышева. — М.: Практическая медицина, 2012. — 72 с.
2. Быков В. Л. Эпителиальные остатки Малассе: тканевая, клеточная и молекулярная биология / В. Л. Быков // Морфология. — 2003, № 4. — С. 95—103.
3. Маянский Д. Н. Хроническое воспаление / Д. Н. Маянский. — М.: Медицина, 1991. — 270 с.
4. Петрова Л. В. Фактор роста эндотелия сосудов как показатель гипоксии тканей, его возможная роль в патогенезе плоского лишая слизистой оболочки рта / Л. В. Петрова, Н. Е. Кушлинский, Л. В. Ильина // Вестник дерматологии и венерологии. — 2004, № 5. — С. 49—54.
5. Романова Ю. М. Цитокины — возможные активаторы роста патогенных бактерий / Ю. М. Романова, А. Л. Гинцбург // Вестник РАМН. — 2000, № 1. — С. 13—17.
6. Тимофеев А. А. Некоторые аспекты патогенеза опухолей и опухолеподобных образований / А. А. Тимофеев, Н. А. Ушко // В кн. «Збірник наукових праць інституту стоматології НМАПО імені П. Л. Шупика». — Київ, 2008. — Вип. 3. — С. 99—102.
7. Bataineh A. B. The prevalence of inflammatory and developmental odontogenic cysts in a Jordanian population: a clinicopathologic study. / A. B. Bataineh, M. A. Rawashdeh, M. A. Al Qudah // Quintessence international. — 2004. — Vol. 32 (2). — P. 12—19.
8. Carmeliet P. Angiogenesis in health and disease / P. Carmeliet // Nature medicine. — 2003. — Vol. 9. — P. 653—660.
9. Carmeliet P. Angiogenesis in life, disease and medicine / P. Carmeliet // Nature medicine. — 2005. — Vol. 438, № 7070. — P. 932—936.
10. Cawson R. A. Cawson`s essentials of oral pathology and oral medicine / R. A. Cawson, E. W. Odell, S. Porter / 7th ed, Churchill Livingstone, Edinburgh, 2002. — P. 102—121.
11. Jones A. Range and demographics of odontogenic cysts diagnosed in a UK population over a 30-year period/ A. Jones, G. Craig, C. Franklin // J. of Oral Pathology & Medicine. — 2006. — Vol. 35 (8). — P. 500—507.
12. Nair P. N. R. Non-microbial etiology: periapical cysts sustain post-treatment apical Periodontitis / P. N. R. Nair // Endodontic Topics. — 2003. — Vol. 6. — P. 96—113.
13. Thornton A. D. Angiogenesis inhibition with bevacizumab and the surgical management of colorectal cancer / A. D. Thornton, P. Ravn, M. Winslet, K. Chester // British Journal of Surgery Society Ltd. — 2006. — Vol. 93, Issue 12. — P. 1456—1463.