Шесть факторов остеоинтеграции. Поверхность. От биоинертности к остеоиндукции.
А. А. Долгалев
д. м. н., главный врач ООО «Северо-Кавказский медицинский учебно-методический центр»
Поверхность имплантата — это ключ к успешной остеоинтеграции, и это является ответом на вопрос, почему ученые включаются в «состязание за поверхность».
Процесс заживления — это тоже состязание между различными веществами и клетками, которые вступают во взаимодействие и срастаются с поверхностью имплантата. От результатов такого состязания зависит прохождение процесса заживления. В этом состязании крайне важную роль играет качество поверхности.
Jan Eirik Ellingsen
Качество имплантационного материала и свойство его поверхности — как две стороны одной медали: вещи неразделяемые. В предыдущей публикации мы говорили о том, что свойства материала диктуют производителю имплантата создание той или иной поверхности, того или иного дизайна имплантата. Анализ свойств существующих имплантационных материалов показывает, что ни один из них не может обладать свойствами, полностью соответствующими функциям натуральной кости. Именно свойства поверхности на сегодняшний день, с точки зрения производителей имплантатов, являются ключом — в прямом и переносном смысле — к успешной остеоинтеграции. Взаимодействие организма с имплантатом напрямую зависит от качества материала, поверхности и формы имплантата. Организм именно через поверхность контактирует с имплантатом, и то, каков будет ответ на эту поверхность, в наибольшей степени определяет уровень остеоинтеграции, а соответственно, течение послеоперационного и реабилитационного периодов. Поэтому одним из перспективных направлений современной имплантологии является разработка оптимальной поверхности имплантата.
В 60-70-х годах ХХ века, в период развития методики Бранемарка, показатель остеоинтеграции имплантатов составлял 60 %. Ко второй трети ХХ века стало известно, что благодаря тому, что на поверхности титана спонтанно образуется прочный окисный слой (преимущественно TiO), представляющий стойкое соединение, на нем при инсталляции титанового имплантата в кость может отлагаться стойкая минерализованная матрица. При этом начальная окисная поверхность с толщиной 50-100 нм покрывается белками плазмы (главным образом фибронектином и витронектином). Важное требование для имплантата — биологическая совместимость — обеспечивается благодаря биологической инертности этой окисной поверхности. Для титановых имплантатов транспорт электронов через границу раздела имплантат — кость ингибируется достаточно толстым пассивирующим окисным слоем, при этом адсорбция белков не сопровождается изменением их конфигурации. И имплантаты производились из химически чистого титана именно по этой причине, но поверхность этих имплантатов оставалась гладкой.
В конце ХХ века работы по модифицированию свойств поверхности имплантатов велись на макроуровне. К этому времени в достаточно широкой практике показатели приживаемости имплантатов равнялись 80 % на верхней и 90 % на нижней челюсти.
Для улучшения остеоинтеграции и придания поверхности имплантата остеокондуктивных свойств в последней четверти ХХ века многие производители покрывали титановые имилаптаты гидроксиапатитовой керамикой, преследуя цель соединения механических свойств титана с хорошим свойством наращивания кости на керамическую поверхность. Но клинические наблюдения показали, что имплантаты, созданные по этим технологиям, себя не оправдали. При покрытии в результате теплового воздействия происходили изменения в керамике, так что, кроме гидроксиапатита, в составе покрытия появлялись примеси, которые загрязняли поверхность имплантата. Хотя и следует отметить, что при этих покрытиях на стадии заживления механическое соединение было значительно выше по сравнению с имплантатами с титановым покрытием, но недостаточная биомеханическая стабильность с высокой биодеградацией керамического покрытия в сроки от года максимум до 5 лет становилась причиной утраты большинства имплантатов. Дополнительную проблему создавало гидроксиапатитовое покрытие при перииимплантарных воспалениях, так как эти поверхности особенно благоприятны для колонизации бактерий.
Еще 15-20 лет назад в имплантологии существовало несколько факторов, которые затрудняли возникновение успешной остеоинтеграции, — это IV тип кости, установка имплантата сразу же после удаления зуба, немедленная нагрузка на имплантат. Тогда же пришло понимание, что улучшение степени формирования и количества формирующейся кости на имплантатах сможет помочь преодолеть подобные трудности. Последние двадцать лет исследователи и производители большое внимания уделяют модифицированию поверхности на микро- и наноуровне (микрометр или микрон, единица длины, равная 10-6 м, нанометр — величина, равная 10-9 м), придавая поверхности имплантата остеоиндуктивные свойства. Это достигается микроструктурированием наружной поверхности имплантата при помощи химической, механической обработки или плазменным напылением. Кроме своей биоактивности, то есть способности образовывать связь с живой костью, такая поверхность проявляет остеокондуктивные свойства, понимаемые как способность выполнять функцию решетки для остеобластов и остеоцитов в процессе постепенного образования новой кости. Остеокондуктивные свойства являются результатом реакций поверхности на жидкие вещества материала и организма, что приводит к образованию костеобразного апатитового слоя на поверхности материала после имплантации. Данный слой является важнейшим остеоиндуктивным фактором, так как апатит концентрирует факторы роста материнской кости, направляя движение мезенхимальных клеток на остеобласты и стимулируя тем самым формирование кости.
Исследования показали, что имплантаты с шероховатой поверхностью обладают более высокими показателями стабильности при выкручивании и вытягивании по сравнению с гладкими имплантатами. Применение имплантатов с шероховатой поверхностью способствует решению ряда проблем, стоящих перед клиницистами. Прорастание костной ткани в такую поверхность усиливает ретенцию и стабилизацию имплантата, увеличивается площадь контакта кость — имплантат, что способствует более благоприятному распределению нагрузок в опорной кости. Кроме того, шероховатая поверхность способствует лучшему формированию кости, чем гладкая. Эти свойства позволяют лучше переносить неблагоприятные условия имплантации, такие как недостаточная стабильность имплантата, несовместимость между имплантатом и костным ложем или костью низкого качества.
Ведущие производители имплантационных систем имеют свои собственные технологии создания шероховатого слоя на поверхности имплантата. Практикующему врачу важно знать о характеристиках поверхности конкретной имплантационной системы для ее осознанного выбора. На какие показатели поверхности следует ориентироваться? В литературе описаны следующие показатели поверхности имплантатов:
Sa — средняя глубина шероховатости;
Sdr — процент увеличения площади поверхности при «разглаживании» ее шероховатости;
Sq — корень из среднего квадратного отклонения глубины профиля шероховатости;
St — расстояние между наивысшей и наинизшей точками;
Ssk — кривизна топографического уровня распределения.
Для практического применения следует обращать внимание на первые два показателя. По степени шероховатости следует различать гладкие, минимально гладкие, умеренно шероховатые, грубые поверхности (табл. № 1). Чтобы понимать, для чего нам нужно знать о степени шероховатости, необходимо помнить классификацию качества кости. Одна из них — по Lekholm и Zarb, предложенная в 1985году. Согласно этой классификации:
класс I — костная ткань челюсти представлена почти полностью гомогенным компактным слоем;
класс II — толстый компактный слой окружает высокоразвитый губчатый слой;
класс III — тонкий компактный слой окружает высокоразвитый губчатый слой;
класс IV — тонкий компактный слой окружает губчатый слой с малой плотностью трабекулярной сети.
Кстати, эта классификация идеально ложится на классификацию степеней шероховатости поверхности имплантатов (табл. № 1).
Таблица № 1. Степени шероховатости поверхности имплантатов
|
Грубость поверхности |
SA (мкм) |
|
Гладкая |
< 0,5 |
|
Минимально грубая |
0,5-1,0 |
|
Умеренно шероховатая |
1,0-2,0 |
|
Грубая |
2,0 и выше |
При I классе применение гладких имплантатов является оправданным, ибо дает оптимальную инсталляцию. При этом площадь соприкосновения не создает участков напряжения в кости. Кстати, таких пациентов совсем немного — по данным литературы, около 7 %.
При II (около 23 % пациентов) и III (53 % пациентов) классах рационально использование имплантатов с минимально грубой или умеренно шероховатой поверхностью.
При IV классе, к которому относится около 17 % пациентов, больший процент успеха дадут имплантаты с грубой поверхностью.
Ведущие компании — производители имплантатов выпускают имплантаты с разными показателями поверхности (табл. № 2).
Таблица № 2. Показатели поверхности некоторых имплантационных систем
|
Имплантационная система |
SA (мкм) |
SDR % |
|
3I |
0,4 |
17 |
|
Astra |
1,1 |
31 |
|
Astra Osseospeed |
1,4 |
37 |
|
Radix |
1,8 |
40 |
|
Implantium |
1,8 |
Нет данных |
|
Frialit-2 |
Выше 2,0 |
Нет данных |
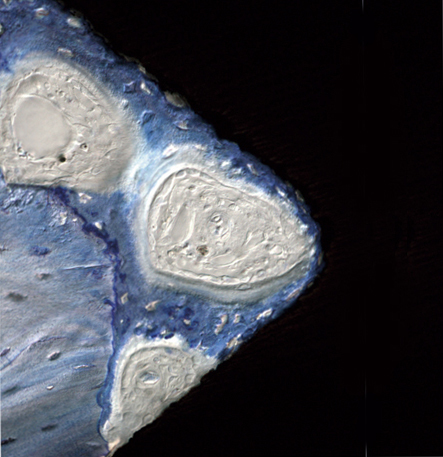
Для расширения показаний к имплантологическому лечению имплантаты стали раньше нагружать, использовать поверхности средней шероховатости вместо относительно гладких или слишком шероховатых. После десятилетней оценки эффективности титановой поверхности TiOblast, подтвержденной многочисленными исследованиями, наступило время для освоения новой технологии изготовления имплантатов производства компании Astra Tech. Усовершенствование технологии заключается в первоначальной пескоструйной обработке поверхности титана частицами оксида титана и проведении последующей процедуры ионной имплантации фторидных ионов в обработанную титановую поверхность. OsseoSpeed — это первая из титановых поверхностей, модифицированных фторидами (рис. 1-2).
- Рис. 1. Фтормодифицированная поверхность титана достигается пескоструйной обработкой поверхности титана частицами оксида титана и проведением процедуры ионной имплантации фторидных ионов.
- Рис. 2. Фтормодифицированная поверхность титана достигается пескоструйной обработкой поверхности титана частицами оксида титана и проведением процедуры ионной имплантации фторидных ионов.
Современные имплантаты выигрывают перед своими предшественниками по двум аспектам: позволяют получить лучшие результаты в кости неудовлетворительного качества, а также ассоциируются с меньшей потерей кости по сравнению с критериями успеха, которые считались приемлемыми в 1986 году. Ранее считалась приемлемой потеря 1 мм кости в первый год после имплантации и менее 0,2 мм в год в последующий период. Вероятно, в будущем мы сможем принять более строгие критерии — это, например, 0,5 мм потеря кости только в первый год и 0,1 мм ежегодно в последующем. Поверхность имплантата может быть активным компонентом клинического успеха. Относительно небольшая, но эффективная модификация поверхности TiOblast фтором приводит к большей дифференциации остеобластов из мезенхимальных стволовых клеток, а также к большему контакту кости с имплантатом in vivo (рис. 3). Преимущества более быстрого и объемного формирования кости вокруг имплантата могут быть достигнуты и использованы в клинической практике.
В то же время создание модифицированных поверхностей не исключает применения имплантатов с гладкой наружной поверхностью, так как во многом выбор типа имплантата зависит от качества костной ткани.
Glauser, проводя исследования на добровольцах, отметил, что мягкие ткани, формирующиеся вокруг экспериментальных мини-имплантатов с различной поверхностью, по своим структуре и составу очень похожи на таковые у животных. Сравнивая качество эпителиального прикрепления к шейкам чресслизистых имплантатов, он констатирует, что в случаях с шероховатой поверхностью наблюдаются меньшее апикальное продвижение эпителия и большая высота соединительной ткани, нежели чем когда поверхность шейки гладкая.
Необходимо признать, что прямой зависимости между типом или фактурой поверхности и риском развития периимплантита на сегодняшний день не установлено, даже если известно, что адгезия бактериального налета к шероховатой поверхности изначально выше. С другой стороны, достоверным является тот факт, что воспаление вокруг имплантатов с шероховатой поверхностью легче поддается лечению. Реостеоинтеграция при шероховатой поверхности выше, чем при гладкой. Добавим, что при лечении периимплантитов с использованием бикарбоната натрия под высоким давлением можно добиться одинаковой степени деконтаминации и шероховатой, и гладкой поверхностей.
Но хотелось бы закончить следующим: имплантологи должны помнить, что имплантаты с развитой поверхностью требуют более дифференцированного применения, более тщательного проведения хирургического протокола (четвертый фактор остеоинтеграции). Об этом поговорим в следующих публикациях.
Иллюстрации представлены: рrofessor Tord Berglundh DDS, Phd, Department of Periodontology, The Sahlgrenska Academy, Göteborg University, Sweden.